Byetta para tratamento de diabetes
Marca: Byetta
Nome genérico: Exenatide
Forma de dosagem: Injeção
Conteúdo:
Descrição
Farmacologia Clínica
Estudos clínicos
Indicações e uso
Contra-indicações
Precauções
Reações adversas
Sobredosagem
Dosagem e Administração
Armazenamento
Como fornecido
Byetta (Exenatide) Informações do Paciente (Em inglês simples)
Descrição
Byetta® (exenatido) é um peptídeo sintético que possui ações miméticas incretinas e foi originalmente identificado no lagarto Heloderma suspeito. Byetta melhora a secreção de insulina dependente de glicose pelas células beta pancreáticas, suprime a secreção de glucagon inadequadamente elevada e diminui o esvaziamento gástrico. O exenatido difere na estrutura química e na ação farmacológica da insulina, sulfonilureias (incluindo Derivados da D-fenilalanina e meglitinidas), biguanidas, tiazolidinedionas e alfa-glucosidase inibidores.
O exenatido é uma amida peptídica de 39 'aminoácidos. O exenatido tem a fórmula empírica C184H282N50O60S e peso molecular de 4186,6 Daltons. A sequência de aminoácidos para o exenatido é mostrada abaixo.
H - His - Gly - Glu - Gly - Thr - Phe - Thr - Ser - Asp - Leu - Ser - Lys - Gln - Met - Glu - Glu - Glu - Ala - Val - Arg - Leu - Phe - Ilha - Glu - Trp - Leu - Lys - Asn - Gly - Gly - Pro - Ser - Ser - Gly - Ala - Pro - Pro - Pro - Ser - NH2
O Byetta é fornecido para injeção subcutânea (SC) como uma solução isotônica estéril e preservada em um cartucho de vidro que foi montado em um injetor de caneta (caneta). Cada mililitro (mL) contém 250 microgramas (mcg) de exenatido sintético, 2,2 mg de metacresol como conservante antimicrobiano, manitol como agente de ajuste da tonicidade e ácido acético glacial e acetato de sódio trihidratado em água para injeção como solução tampão a pH 4,5. Duas canetas pré-cheias estão disponíveis para fornecer doses unitárias de 5 mcg ou 10 mcg. Cada caneta pré-cheia administrará 60 doses para fornecer 30 dias de administração duas vezes ao dia (BID).
topo
Farmacologia Clínica
Mecanismo de ação
As incretinas, como o peptídeo 1 do tipo glucagon (GLP-1), aumentam a secreção de insulina dependente de glicose e exibem outras ações anti-hiperglicêmicas após sua liberação na circulação a partir do intestino. O exenatido é um agente mimético da incretina que imita o aumento da secreção de insulina dependente de glicose e várias outras ações anti-hiperglicêmicas das incretinas.
A sequência de aminoácidos do exenatido se sobrepõe parcialmente à do GLP-1 humano. Foi demonstrado que o exenatido se liga e ativa o receptor GLP-1 humano conhecido in vitro. Isso leva a um aumento na síntese de insulina dependente de glicose e na secreção in vivo de insulina das células beta pancreáticas, por mecanismos que envolvem AMP cíclico e / ou outra sinalização intracelular caminhos. O exenatido promove a liberação de insulina das células beta na presença de concentrações elevadas de glicose. Quando administrado in vivo, o exenatido imita certas ações anti-hiperglicêmicas do GLP-1.
Byetta melhora o controle glicêmico, reduzindo as concentrações de glicose em jejum e pós-prandial em pacientes com diabetes tipo 2 através das ações descritas abaixo.
Secreção de insulina dependente de glicose: Byetta tem efeitos agudos na resposta das células beta pancreáticas à glicose e leva à liberação de insulina apenas na presença de concentrações elevadas de glicose. Essa secreção de insulina diminui à medida que as concentrações de glicose no sangue diminuem e se aproximam da euglicemia.
Resposta insulínica de primeira fase: em indivíduos saudáveis, ocorre secreção robusta de insulina durante os primeiros 10 minutos após a administração intravenosa de glicose (IV). Essa secreção, conhecida como "resposta insulínica de primeira fase", está caracteristicamente ausente em pacientes com diabetes tipo 2. A perda da resposta insulínica de primeira fase é um defeito precoce das células beta no diabetes tipo 2. A administração de Byetta em concentrações plasmáticas terapêuticas restaurou a resposta da insulina da primeira fase a um bolus IV de glicose em pacientes com diabetes tipo 2 (Figura 1). A secreção de insulina de primeira fase e a secreção de insulina de segunda fase aumentaram significativamente em pacientes com diabetes tipo 2 tratados com Byetta em comparação com solução salina (p
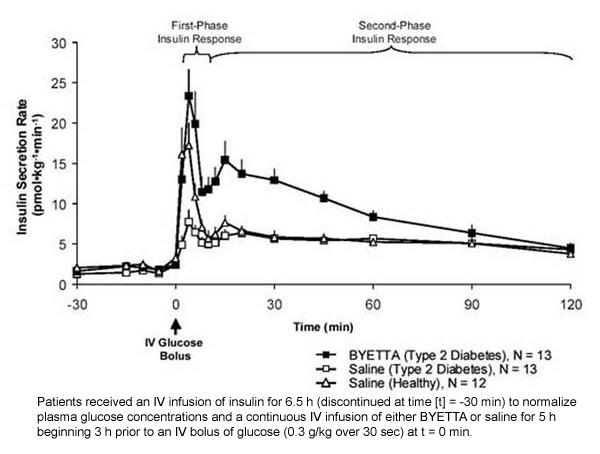
Figura 1: Taxa média de secreção de insulina (+ SEM) durante a infusão de Byetta ou solução salina em pacientes com diabetes tipo 2 e durante a infusão de solução salina em indivíduos saudáveis
Secreção de glucagon: Em pacientes com diabetes tipo 2, Byetta modera a secreção de glucagon e reduz as concentrações séricas de glucagon durante os períodos de hiperglicemia. Concentrações mais baixas de glucagon levam à diminuição da produção hepática de glicose e à demanda de insulina. No entanto, Byetta não prejudica a resposta normal do glucagon à hipoglicemia.
Esvaziamento gástrico: Byetta diminui o esvaziamento gástrico, reduzindo assim a taxa na qual a glicose derivada da refeição aparece na circulação.
Ingestão de alimentos: tanto em animais quanto em humanos, foi demonstrado que a administração de exenatido reduz a ingestão de alimentos.
Farmacocinética
Absorção
Após a administração de CE em pacientes com diabetes tipo 2, o exenatido atinge o pico médio das concentrações plasmáticas em 2,1 h. Pico médio da concentração de exenatido (Cmax) foi de 211 pg / mL e a área média geral sob a curva (AUC0-inf) foi de 1036 pg-h / mL após a administração por SC de uma dose de 10 mcg de Byetta. A exposição ao exenatido (AUC) aumentou proporcionalmente no intervalo de doses terapêuticas de 5 mcg a 10 mcg. Os valores de Cmax aumentaram menos que proporcionalmente na mesma faixa. Exposição semelhante é alcançada com a administração de Byetta por SC no abdômen, coxa ou braço.
Distribuição
O volume médio aparente de distribuição do exenatido após a administração por SC de uma dose única de Byetta é de 28,3 L.
Metabolismo e Eliminação
Estudos não clínicos demonstraram que o exenatido é predominantemente eliminado por filtração glomerular com subsequente degradação proteolítica. A depuração aparente média do exenatido no ser humano é de 9,1 L / h e a meia-vida terminal média é de 2,4 h. Estas características farmacocinéticas do exenatido são independentes da dose. Na maioria dos indivíduos, as concentrações de exenatido são mensuráveis por aproximadamente 10 h após a dose.
Populações Especiais
Insuficiência renal
Em pacientes com insuficiência renal leve a moderada (depuração da creatinina de 30 a 80 mL / min), a depuração do exenatido foi apenas levemente reduzida; portanto, não é necessário ajuste posológico de Byetta em pacientes com insuficiência renal leve a moderada. Contudo, em doentes com doença renal em fase terminal em diálise, a depuração média do exenatido é reduzida para 0,9 L / h em comparação com 9,1 L / h em indivíduos saudáveis (ver PRECAUÇÕESGeral).
Insuficiência hepática
Nenhum estudo farmacocinético foi realizado em pacientes com diagnóstico de insuficiência hepática aguda ou crônica. Como o exenatido é eliminado principalmente pelo rim, não se espera que a disfunção hepática afete as concentrações sanguíneas de exenatido (consulte Farmacocinética, Metabolismo e Eliminação).
Geriátrico
A análise farmacocinética populacional dos pacientes (de 22 a 73 anos) sugere que a idade não influencia as propriedades farmacocinéticas do exenatido.
Pediatria
Exenatida não foi estudado em doentes pediátricos.
Gênero
A análise farmacocinética populacional de pacientes do sexo masculino e feminino sugere que o sexo não influencia a distribuição e eliminação do exenatido.
Raça
A análise farmacocinética populacional de pacientes, incluindo caucasianos, hispânicos e negros, sugere que a raça não tem influência significativa na farmacocinética do exenatido.
Obesidade
A análise farmacocinética da população de pacientes obesos (IMC <30 kg / m2) e não obesos sugere que a obesidade não tem efeito significativo na farmacocinética do exenatido.
Interações medicamentosas
Digoxina
A administração concomitante de doses repetidas de Byetta (10 mcg BID) diminuiu a Cmax de digoxina oral (0,25 mg QD) em 17% e atrasou a Tmax em aproximadamente 2,5 h; no entanto, a exposição farmacocinética geral (AUC) não foi alterada.
Lovastatina
A AUC e Cmax da lovastatina diminuíram aproximadamente 40% e 28%, respectivamente, e a Tmax foi adiada cerca de 4 h quando Byetta (10 mcg BID) foi administrado concomitantemente com uma dose única de lovastatina (40 mg) em comparação com a lovastatina administrada sozinho. Nos ensaios clínicos controlados de 30 semanas de Byetta, o uso de Byetta em pacientes que já recebem HMG Inibidores da CoA redutase não foram associados a alterações consistentes nos perfis lipídicos em comparação com linha de base.
Lisinopril
Em pacientes com hipertensão leve a moderada estabilizada com lisinopril (5 a 20 mg / dia), o Byetta (10 mcg BID) não alterou a Cmax no estado de equilíbrio ou a AUC do lisinopril. Lisinopril T em estado estacionáriomax foi adiado por 2 h. Não houve alterações na pressão arterial sistólica e diastólica média de 24 horas.
Acetaminofeno
Quando 1000 mg de acetaminofeno elixir foram administrados com 10 mcg de Byetta (0 h) e 1 h, 2 h e 4 h após a injeção de Byetta, as AUC do acetaminofeno diminuíram 21%, 23%, 24% e 14%, respectivamente; Cmax diminuiu 37%, 56%, 54% e 41%, respectivamente; Tmax foi aumentado de 0,6 h no período de controle para 0,9 h, 4,2 h, 3,3 h e 1,6 h, respectivamente. AUC do acetaminofeno, Cmax e Tmax não foram alterados significativamente quando o acetaminofeno foi administrado 1 h antes da injeção de Byetta.
Varfarina
A co-administração de doses repetidas de Byetta (5 mcg BID nos dias 1-2 e 10 mcg BID nos dias 3-9) em voluntários saudáveis, atrasou a warfarina (25 mg) Tmax em cerca de 2 h. Não foram observados efeitos clinicamente relevantes na Cmax ou na AUC dos enantiómeros S e R da varfarina. Byetta não alterou as propriedades farmacodinâmicas (avaliadas pela resposta do INR) da varfarina.
Farmacodinâmica
Glicose pós-prandial
Em pacientes com diabetes tipo 2, Byetta reduz as concentrações de glicose no plasma pós-prandial (Figura 2).
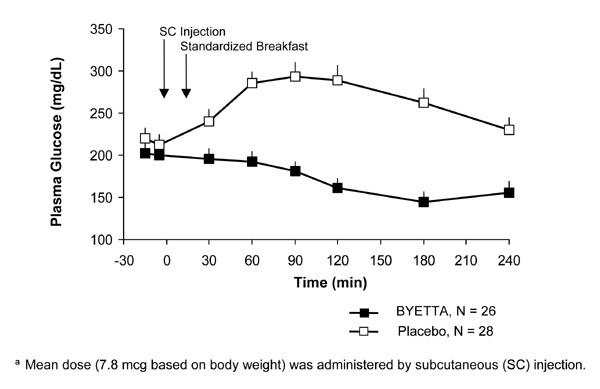
Figura 2: Concentrações médias (+ SEM) de glicose no plasma pós-prandial no dia 1 de Byettauma Tratamento em pacientes com diabetes tipo 2 tratados com metformina, sulfonilureia ou ambos (N = 54)
Glicose em jejum
Em um estudo cruzado de dose única em pacientes com diabetes tipo 2 e hiperglicemia em jejum, uma liberação imediata de insulina ocorreu após a injeção de Byetta. As concentrações de glicose no plasma foram significativamente reduzidas com o Byetta em comparação com o placebo (Figura 3).
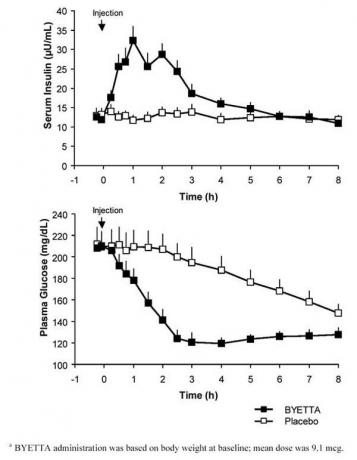
Figura 3: Concentrações médias de insulina e glicemia plasmática (+ SEM) após uma injeção única de Byettauma ou placebo em pacientes em jejum com diabetes tipo 2 (N = 12)
topo
Estudos clínicos
Use com metformina e / ou sulfonilureia
Foram realizados três ensaios clínicos de 30 semanas, duplo-cegos e controlados por placebo para avaliar a segurança e eficácia de Byetta em pacientes com 2 diabetes cujo controle glicêmico foi inadequado com metformina isolada, sulfonilureia isolada ou metformina associada a um sulfonilureia.
Um total de 1446 pacientes foram randomizados nesses três estudos: 991 (68,5%) eram caucasianos, 224 (15,5%) eram hispânicos e 174 (12,0%) eram negros. Os valores médios de HbA1c na linha de base para os ensaios variaram de 8,2% a 8,7%. Após um período inicial de 4 semanas com placebo, os pacientes foram aleatoriamente designados para receber Byetta 5 mcg BID, Byetta 10 mcg, ou placebo, antes das refeições da manhã e da noite, além de seus antidiabéticos orais existentes agente. Todos os pacientes designados para Byetta iniciaram um período de início do tratamento com 5 mcg de DIP por 4 semanas. Após 4 semanas, esses pacientes continuaram recebendo Byetta 5 mcg BID ou tiveram sua dose aumentada para 10 mcg BID. Os pacientes designados para o placebo receberam placebo durante o estudo.
O endpoint primário em cada estudo foi a alteração média da HbA basal1c às 30 semanas. Os resultados do estudo de trinta semanas estão resumidos na Tabela 1.
Tabela 1: Resultados de ensaios clínicos de Byetta controlados por placebo de trinta semanas em pacientes com controle inadequado de glicose, apesar do uso de metformina, uma sulfonilureia ou ambas
| Placebo LICITAÇÃO |
Byetta 5 mcg BID |
Byetta 10 mcg* LICITAÇÃO |
|
|---|---|---|---|
| |||
| Em combinação com metformina | |||
| População com Intenção de Tratar (N) | 113 | 110 | 113 |
| HbA1c (%), Significar | |||
| Linha de base | 8.2 | 8.3 | 8.2 |
| Mudança na semana 30 | +0.1 | −0.4†| −0.8c |
| Proporção que atinge HbA1c≤7% § | 13.0% | 31.6%†| 46.4%†|
| Peso Corporal (kg), Média | |||
| Linha de base | 99.9 | 100.0 | 100.9 |
| Mudança na semana 30 | −0.3 | −1.6†| −2.8c |
| Em combinação com uma sulfonilureia | |||
| População com Intenção de Tratar (N) | 123 | 125 | 129 |
| HbA1c (%), Significar | |||
| Linha de base | 8.7 | 8.5 | 8.6 |
| Mudança na semana 30 | +0.1 | −0.5†| −0.9c |
| Proporção que atinge HbA1c≤7% § | 8.8% | 32.6%†| 41.3%c |
| Peso Corporal (kg), Média | |||
| Linha de base | 99.1 | 94.9 | 95.2 |
| Mudança na semana 30 | −0.6 | −0.9 | −1.6†|
| Em combinação com metformina e uma sulfonilureia | |||
| População com Intenção de Tratar (N) | 247 | 245 | 241 |
| HbA1c (%), Significar | |||
| Linha de base | 8.5 | 8.5 | 8.5 |
| Mudança na semana 30 | +0.2 | −0.6c | −0.8c |
| Proporção que atinge HbA1c≤7% § | 9.2% | 27.4%c | 33.5%c |
| Peso Corporal (kg), Média | |||
| Linha de base | 99.1 | 96.9 | 98.4 |
| Mudança na semana 30 | −0.9 | −1.6†| −1.6†|
HbA1c
A adição de Byetta a um regime de metformina, uma sulfonilureia, ou ambas, resultou em reduções estatisticamente significativas da HbA basal1c na semana 30, em comparação com os pacientes que receberam placebo adicionados a esses agentes nos três estudos controlados (tabela 1). Além disso, foi observado um efeito-dose estatisticamente significativo entre os grupos de 5 mcg e 10 mcg de Byetta para a alteração da linha de base HbA1c na semana 30 nos três estudos.
Glicose em jejum e pós-prandial
O uso prolongado de Byetta em combinação com metformina, uma sulfonilureia ou ambas reduziu o jejum e concentrações plasmáticas pós-prandiais de glicose de maneira estatisticamente significativa e dependente da dose, durante 30. Uma redução estatisticamente significativa desde o início, tanto nas concentrações médias de glicemia de jejum quanto pós-prandial foi observado na semana 30 nos dois grupos Byetta em comparação com o placebo nos dados combinados dos três grupos ensaios. A alteração na concentração de glicose em jejum na semana 30, em comparação com a linha de base, foi de 8 mg / dL para Byetta 5 mcg BID e de 10 mg / dL para Byetta 10 mcg BID, em comparação com +12 mg / dL para placebo. A alteração na concentração de glicose pós-prandial após 2 horas da administração de Byetta na semana 30 comparou na linha de base foi '63 mg / dL para 5 mcg BID e '71 mg / dL para 10 mcg BID, em comparação com +11 mg / dL para placebo.
Proporção de pacientes que atingem HbA1c≤7%
Byetta em combinação com metformina, uma sulfonilureia, ou ambas, resultou em uma maior e estatisticamente significativa proporção de pacientes que atingiram um HbA1c <7% na semana 30 em comparação com pacientes que receberam placebo em combinação com esses agentes (tabela 1).
Peso corporal
Nos três ensaios controlados, uma diminuição do peso corporal basal na semana 30 foi associada ao Byetta 10 mcg BID em comparação com o placebo BID em pacientes com diabetes tipo 2 (tabela 1).
Resultados clínicos de um ano
A coorte de 163 pacientes dos ensaios controlados por placebo de 30 semanas que completaram um total de 52 semanas de tratamento com Byetta 10 mcg BID apresentou alterações de HbA1c da linha de base de "1,0% e" 1,1% às 30 e 52 semanas de tratamento, respectivamente, com alterações acompanhantes da linha de base na glicose plasmática em jejum de "14,0 mg / dL e" 25,3 mg / dL, e alterações no peso corporal de "2,6 kg e" 3,6 kg. Essa coorte teve valores basais semelhantes aos de toda a população de estudos controlados.
Use com uma tiazolidinediona
Em um estudo randomizado, duplo-cego, controlado por placebo, com duração de 16 semanas, Byetta (n = 121) ou placebo (n = 112) foi adicionado aos tratamento com tiazolidinediona (pioglitazona ou rosiglitazona), com ou sem metformina, em pacientes com diabetes tipo 2 com insuficiência controle glicêmico. A randomização para Byetta ou placebo foi estratificada com base no fato de os pacientes estarem recebendo metformina. Os pacientes designados para o placebo receberam placebo durante o estudo. Byetta ou placebo foi injetado por via subcutânea antes das refeições da manhã e da noite. Setenta e nove por cento dos pacientes usavam tiazolidinediona e metformina e 21% usavam tiazolidinediona sozinha. A maioria dos pacientes (84%) era caucasiana, 8% era hispânica e 3% era negra. Os valores médios basais de HbA1c foram semelhantes para Byetta e placebo (7,9%). O tratamento com Byetta foi iniciado com uma dose de 5 mcg BID por 4 semanas e depois aumentou para 10 mcg BID por mais 12 semanas.
Os resultados do estudo de dezesseis semanas estão resumidos na Tabela 2. Comparado ao placebo, o Byetta resultou em reduções estatisticamente significativas da HbA1c em relação à linha de base na semana 16. Os efeitos do tratamento para HbA1c foram semelhantes nos dois subgrupos definidos pelo estrato de tratamento subjacente (tiazolidinedionas isoladas versus tiazolidinedionas mais metformina). A alteração na concentração sérica de glicose em jejum da linha de base para a Semana 16 foi estatisticamente significativa em comparação com o placebo (-21 mg / dL para Byetta 10 mcg BID em comparação com +4 mg / dL para placebo).
Tabela 2: Resultados do ensaio de 16 semanas controlado por placebo de Byetta em pacientes com controle inadequado da glicose, apesar do uso de tiazolidinediona (TZD) ou tiazolidinediona mais metformina
| Placebo LICITAÇÃO |
Byetta 10 mcg* LICITAÇÃO |
|
|---|---|---|
| ||
| Em combinação com um TZD ou um TZD plus MET | ||
| População com Intenção de Tratar (N) | 112 | 121 |
| HbA1c (%), Significar | ||
| Linha de base | 7.9 | 7.9 |
| Mudança na semana 16 | +0.1 | −0.8†|
| Proporção que atinge HbA1c≤7%c | 16.2% | 62.3%†|
| Peso Corporal (kg), Média | ||
| Linha de base | 96.9 | 97.5 |
| Mudança na semana 16 | −0.2 | −1.5†|
topo
Indicações e uso
O Byetta é indicado como terapia adjuvante para melhorar o controle glicêmico em pacientes com diabetes mellitus tipo 2 em uso de metformina, sulfonilureia, tiazolidinediona, uma combinação de metformina e uma sulfonilureia, ou uma combinação de metformina e uma tiazolidinediona, mas não alcançaram glicemia adequada ao controle.
topo
Contra-indicações
Byetta está contra-indicado em pacientes com hipersensibilidade conhecida ao exenatido ou a qualquer um dos componentes do produto.
topo
Precauções
Geral
Byetta não substitui a insulina em pacientes que necessitam de insulina. Byetta não deve ser utilizado em doentes com diabetes tipo 1 ou no tratamento da cetoacidose diabética.
Os pacientes podem desenvolver anticorpos anti-exenatido após o tratamento com Byetta, consistente com as propriedades potencialmente imunogênicas de produtos farmacêuticos de proteínas e peptídeos. Os pacientes que recebem Byetta devem ser observados quanto a sinais e sintomas de reações de hipersensibilidade.
Em uma pequena proporção de pacientes, a formação de anticorpos anti-exenatido em altos títulos pode resultar em falha na obtenção de melhora adequada no controle glicêmico. Se houver piora no controle glicêmico ou falha em atingir o controle glicêmico direcionado, deve-se considerar terapia antidiabética alternativa.
O uso concomitante de Byetta com insulina, derivados da D-fenilalanina, meglitinidas ou inibidores da alfa-glucosidase não foi estudado.
Byetta não é recomendado em doentes com doença renal terminal ou insuficiência renal grave (farmacocinética da depuração da creatinina, populações especiais). Em doentes com doença renal em fase terminal em diálise, doses únicas de Byetta 5 mcg não foram bem toleradas devido a efeitos secundários gastrointestinais.
Ocorreram eventos raros e espontaneamente notificados de função renal alterada, incluindo aumento da concentração sérica creatinina, insuficiência renal, insuficiência renal crônica agravada e insuficiência renal aguda, às vezes exigindo hemodiálise. Alguns desses eventos ocorreram em pacientes que receberam um ou mais agentes farmacológicos conhecidos por afetar a função renal. função / estado de hidratação e / ou em pacientes com náusea, vômito e / ou diarréia, com ou sem desidratação. Os agentes concomitantes incluíram inibidores da enzima de conversão da angiotensina, anti-inflamatórios não esteróides e diuréticos. Foi observada reversibilidade da função renal alterada com tratamento de suporte e descontinuação de agentes potencialmente causadores, incluindo exenatido. O exenatido não demonstrou ser diretamente nefrotóxico em estudos pré-clínicos ou clínicos.
Byetta não foi estudado em doentes com doença gastrointestinal grave, incluindo gastroparesia. Seu uso é comumente associado a efeitos adversos gastrointestinais, incluindo náusea, vômito e diarréia. Portanto, o uso de Byetta não é recomendado em pacientes com doença gastrointestinal grave. O desenvolvimento de dor abdominal intensa em um paciente tratado com Byetta deve ser investigado, pois pode ser um sinal de alerta de uma condição grave.
Hipoglicemia
Nos ensaios clínicos controlados de 30 semanas com Byetta, um episódio de hipoglicemia foi registrado como um evento adverso se o paciente relatou sintomas associados à hipoglicemia com uma glicose no sangue associada. ADMINISTRAÇÃO).
Tabela 3: Incidência (%) de hipoglicemia * por terapia antidiabética concomitante
| Byetta | Byetta | Byetta | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Placebo LICITAÇÃO |
5 mcg LICITAÇÃO |
10 mcg LICITAÇÃO |
Placebo LICITAÇÃO |
5 mcg LICITAÇÃO |
10 mcg LICITAÇÃO |
Placebo LICITAÇÃO |
5 mcg LICITAÇÃO |
10 mcg LICITAÇÃO |
|
| Com metformina | Com uma sulfonilureia | Com MET / SFU | |||||||
| Byetta e placebo foram administrados antes das refeições da manhã e da noite. | |||||||||
| Abreviações: BID, duas vezes por dia; MET / SFU, metformina e uma sulfonilureia. | |||||||||
| |||||||||
| N | 113 | 110 | 113 | 123 | 125 | 129 | 247 | 245 | 241 |
| Hipoglicemia | 5.3% | 4.5% | 5.3% | 3.3% | 14.4% | 35.7% | 12.6% | 19.2% | 27.8% |
Quando usada como complemento de uma tiazolidinediona, com ou sem metformina, a incidência de hipoglicemia leve a moderada sintomática com Byetta foi de 11% em comparação a 7% com placebo.
Byetta não alterou as respostas hormonais contra-reguladoras à hipoglicemia induzida por insulina em um estudo randomizado, duplo-cego e controlado em indivíduos saudáveis.
Informação para Pacientes
Os pacientes devem ser informados dos riscos potenciais de Byetta. Os pacientes também devem ser totalmente informados sobre as práticas de autogestão, incluindo a importância do armazenamento adequado de Byetta, técnica, tempo de dosagem de Byetta e medicamentos orais concomitantes, adesão ao planejamento das refeições, atividade física regular, monitorização da glicemia e teste de HbA1c, reconhecimento e tratamento de hipoglicemia e hiperglicemia e avaliação de diabetes complicações.
Os pacientes devem ser aconselhados a informar seus médicos se estiverem grávidas ou pretenderem engravidar.
Cada dose de Byetta deve ser administrada como uma injeção de CE na coxa, abdômen ou parte superior do braço a qualquer momento dentro do Período de 60 minutos antes das refeições da manhã e da noite (ou antes das duas refeições principais do dia, aproximadamente 6 horas ou mais separados). Byetta não deve ser administrado após uma refeição. Se faltar uma dose, o regime de tratamento deve ser retomado conforme prescrito com a próxima dose programada.
O risco de hipoglicemia aumenta quando Byetta é usado em combinação com um agente que induz hipoglicemia, como uma sulfonilureia. Os sintomas, tratamento e condições que predispõem ao desenvolvimento de hipoglicemia devem ser explicados ao paciente. Embora as instruções usuais do paciente para tratamento da hipoglicemia não precisem ser alteradas, essas instruções devem ser revisado e reforçado ao iniciar a terapia com Byetta, particularmente quando administrado concomitantemente com uma sulfonilureia (Vejo PRECAUÇÕES, Hipoglicemia).
Os doentes devem ser avisados de que o tratamento com Byetta pode resultar numa redução do apetite, e / ou peso corporal, e que não há necessidade de modificar o regime de dosagem devido a tal efeitos O tratamento com Byetta também pode resultar em náusea, particularmente no início do tratamento (ver REAÇÕES ADVERSAS).
O paciente deve ler o folheto "Informações para o paciente" e o Manual do Usuário da Caneta antes de iniciar o tratamento com Byetta e revê-los sempre que a prescrição for recarregada. O paciente deve ser instruído sobre o uso e armazenamento adequados da caneta, enfatizando como e quando instalar uma nova caneta e observando que apenas uma etapa de configuração é necessária no uso inicial. O paciente deve ser avisado para não compartilhar a caneta e as agulhas.
Os pacientes devem ser informados de que as agulhas da caneta não estão incluídas na caneta e devem ser adquiridas separadamente. Os pacientes devem ser informados sobre o comprimento e a bitola da agulha.
Interações medicamentosas
O efeito de Byetta em retardar o esvaziamento gástrico pode reduzir a extensão e a taxa de absorção dos medicamentos administrados por via oral. Byetta deve ser usado com cautela em pacientes que recebem medicações orais que requerem rápida absorção gastrointestinal. Para medicamentos orais que dependem das concentrações limiares de eficácia, como contraceptivos e antibióticos, os pacientes devem ser aconselhados a tomar esses medicamentos pelo menos 1 hora antes Injeção de Byetta. Se esses medicamentos forem administrados com alimentos, os pacientes devem ser aconselhados a tomá-los com uma refeição ou lanche quando Byetta não for administrado. O efeito de Byetta na absorção e eficácia dos contraceptivos orais não foi caracterizado.
Varfarina
Num estudo farmacológico clínico controlado em voluntários saudáveis, foi observado um atraso na varfarina Tmax de cerca de 2 h quando a varfarina foi administrada 30 minutos após o Byetta. Não foram observados efeitos clinicamente relevantes na Cmax ou na AUC. No entanto, desde a introdução no mercado, houve casos relatados espontaneamente de aumento da INR (International Normalized Ratio) com uso concomitante de varfarina e Byetta, algumas vezes associado a sangramento.
Carcinogênese, mutagênese, comprometimento da fertilidade
Foi realizado um estudo de carcinogenicidade de 104 semanas em ratos machos e fêmeas nas doses de 18, 70 ou 250 mcg / kg / dia administradas por injeção em bolus de SC. Adenomas de células C da tireóide benignos foram observados em ratos fêmeas em todas as doses de exenatido. As incidências em ratos fêmeas foram 8% e 5% nos dois grupos controle e 14%, 11% e 23% nos grupos de baixa, média e alta dose com exposições sistêmicas de 5, 22 e 130 vezes, respectivamente, a exposição humana resultante da dose máxima recomendada de 20 mcg / dia, com base na área plasmática sob a curva (AUC).
Em um estudo de carcinogenicidade de 104 semanas em camundongos nas doses de 18, 70 ou 250 mcg / kg / dia administradas por injeção em bolus de SC, nenhuma evidência de tumor foi observada em doses de até 250 mcg / kg / dia, uma exposição sistêmica de até 95 vezes a exposição humana resultante da dose máxima recomendada de 20 mcg / dia, com base em AUC.
O exenatido não foi mutagênico ou clastogênico, com ou sem ativação metabólica, no ensaio de mutagenicidade bacteriana de Ames ou no teste de aberração cromossômica em células de ovário de hamster chinês. O exenatido foi negativo no ensaio in vivo de micronúcleos de camundongo.
Em estudos de fertilidade de camundongos com doses de SC de 6, 68 ou 760 mcg / kg / dia, os machos foram tratados por 4 semanas antes para e durante o acasalamento e as fêmeas foram tratadas 2 semanas antes e durante o acasalamento até o dia da gestação 7. Não foi observado efeito adverso na fertilidade a 760 mcg / kg / dia, uma exposição sistêmica 390 vezes a exposição humana resultante da dose máxima recomendada de 20 mcg / dia, com base na AUC.
Gravidez
Gravidez Categoria C
Foi demonstrado que o exenatido causa crescimento fetal e neonatal reduzido e efeitos esqueléticos em camundongos exposições sistémicas 3 vezes a exposição humana resultante da dose máxima recomendada de 20 mcg / dia, com base na AUC. Foi demonstrado que o exenatido causa efeitos esqueléticos em coelhos em exposições sistêmicas 12 vezes a exposição humana resultante da dose máxima recomendada de 20 mcg / dia, com base na AUC. Não existem estudos adequados e bem controlados em mulheres grávidas. Byetta deve ser utilizado durante a gravidez apenas se o benefício potencial justificar o risco potencial para o feto.
Em camundongas que receberam doses de SC de 6, 68 ou 760 mcg / kg / dia, iniciando 2 semanas antes e durante o acasalamento até o dia 7 da gestação, não houve reação fetal efeitos em doses de até 760 mcg / kg / dia, exposições sistêmicas até 390 vezes a exposição humana resultante da dose máxima recomendada de 20 mcg / dia, com base em AUC.
Em camundongos grávidas que receberam doses de SC de 6, 68, 460 ou 760 mcg / kg / dia dos dias 6 a 15 de gestação (organogênese), fenda palatina (algumas com orifícios) e esquelético irregular a ossificação dos ossos das costelas e do crânio foi observada a 6 mcg / kg / dia, uma exposição sistêmica três vezes a exposição humana resultante da dose máxima recomendada de 20 mcg / kg / dia, com base na AUC.
Em coelhos prenhes que receberam doses de SC de 0,2, 2, 22, 156 ou 260 mcg / kg / dia entre os dias 6 a 18 de gestação (organogênese), lesões esqueléticas irregulares foram observadas ossificações a 2 mcg / kg / dia, uma exposição sistêmica 12 vezes a exposição humana resultante da dose máxima recomendada de 20 mcg / dia, com base na AUC.
Em camundongos grávidas que receberam doses de SC de 6, 68 ou 760 mcg / kg / dia desde o dia 6 da gestação até o dia 20 da lactação (desmame), observou-se um número aumentado de mortes neonatais nos dias 2-4 após o parto, em mães que receberam 6 mcg / kg / dia, uma exposição sistêmica 3 vezes a exposição humana resultante da dose máxima recomendada de 20 mcg / dia, com base na AUC.
Mães que amamentam
Não se sabe se o exenatido é excretado no leite humano. Muitos medicamentos são excretados no leite humano e, devido ao potencial de reações adversas clinicamente significativas em lactentes do exenatido, uma decisão deve-se descontinuar a produção de leite para consumo ou descontinuar o medicamento, levando em consideração a importância do medicamento para a lactação mulher. Estudos em camundongos lactantes demonstraram que o exenatido está presente em baixas concentrações no leite (menor ou igual a 2,5% da concentração no plasma materno após administração subcutânea). Deve-se tomar cuidado quando Byetta é administrado a uma mulher que amamenta.
Uso pediátrico
A segurança e eficácia de Byetta não foram estabelecidas em pacientes pediátricos.
Uso Geriátrico
Byetta foi estudado em 282 pacientes com 65 anos ou mais e em 16 pacientes com 75 anos ou mais. Não foram observadas diferenças de segurança ou eficácia entre esses pacientes e os pacientes mais jovens.
topo
Reações adversas
Use com metformina e / ou sulfonilureia
Nos três ensaios controlados de 30 semanas de Byetta adicionados à metformina e / ou sulfonilureia, eventos adversos com uma incidência> 5% (excluindo hipoglicemia; Vejo Tabela 3) que ocorreram com mais frequência em pacientes tratados com Byetta em comparação com pacientes tratados com placebo estão resumidos na Tabela 4.
Tabela 4: Eventos adversos emergentes do tratamento frequente (≥ 5% de incidência e maior incidência de tratamento com Byetta) excluindo hipoglicemia *
| Placebo BID N = 483 % |
All Byetta BID N = 963 % |
|
|---|---|---|
| ||
| Náusea | 18 | 44 |
| Vômito | 4 | 13 |
| Diarréia | 6 | 13 |
| Sentindo-se nervoso | 4 | 9 |
| Tontura | 6 | 9 |
| Dor de cabeça | 6 | 9 |
| Dispepsia | 3 | 6 |
Os eventos adversos associados ao Byetta geralmente foram de intensidade leve a moderada. O evento adverso mais frequentemente relatado, náusea leve a moderada, ocorreu de maneira dependente da dose. Com a terapia continuada, a frequência e a gravidade diminuíram ao longo do tempo na maioria dos pacientes que inicialmente experimentaram náusea. Eventos adversos relatados em <1,0 a <5,0% dos pacientes recebendo Byetta e relatados com mais frequência do que com placebo astenia (relatada principalmente como fraqueza), diminuição do apetite, doença do refluxo gastroesofágico e hiperidrose. Os pacientes nos estudos de extensão às 52 semanas experimentaram tipos semelhantes de eventos adversos observados nos ensaios controlados de 30 semanas.
A incidência de abstinência devido a eventos adversos foi de 7% para pacientes tratados com Byetta e de 3% para pacientes tratados com placebo. Os eventos adversos mais comuns que levaram à retirada de pacientes tratados com Byetta foram náusea (3% dos pacientes) e vômito (1%). Para pacientes tratados com placebo, <1% se retirou devido a náusea e 0% devido a vômito.
Use com uma tiazolidinediona
No estudo de 16 semanas, controlado por placebo, de Byetta, associado a tiazolidinediona, com ou sem metformina, a incidência e o tipo de outros eventos adversos observados foram semelhantes aos observados nos ensaios clínicos controlados de 30 semanas com metformina e / ou sulfonilureia. Não foram relatados eventos adversos graves no braço do placebo. Dois eventos adversos sérios, como dor no peito (levando à retirada) e pneumonite de hipersensibilidade crônica, foram relatados no braço Byetta.
A incidência de abstinência devido a eventos adversos foi de 16% (19/121) para pacientes tratados com Byetta e de 2% (2/112) para pacientes tratados com placebo. Os eventos adversos mais comuns que levaram à retirada dos pacientes tratados com Byetta foram náusea (9%) e vômito (5%). Para pacientes tratados com placebo, <1% se retirou devido a náusea. Calafrios (n = 4) e reações no local da injeção (n = 2) ocorreram apenas em pacientes tratados com Byetta. Os dois pacientes que relataram uma reação no local da injeção apresentaram altos títulos de anticorpo anti-exenatido.
Dados espontâneos
Desde a introdução do Byetta no mercado, foram relatadas as seguintes reações adversas adicionais. Como esses eventos são relatados voluntariamente em uma população de tamanho incerto, nem sempre é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição a drogas.
Geral: reações no local da injeção; disgeusia; sonolência, o INR aumentou com o uso concomitante de varfarina (alguns relatos associados ao sangramento).
Alergia / Hipersensibilidade: prurido generalizado e / ou urticária, erupção cutânea macular ou papular, angioedema; relatos raros de reação anafilática.
Gastrointestinal: náusea, vômito e / ou diarréia, resultando em desidratação; distensão abdominal, dor abdominal, eructação, constipação, flatulência, pancreatite aguda.
Distúrbios renais e urinários: função renal alterada, incluindo insuficiência renal aguda, piora da insuficiência renal crônica, insuficiência renal, aumento da creatinina sérica (ver PRECAUÇÕES).
Imunogenicidade
Consistente com as propriedades potencialmente imunogênicas dos produtos farmacêuticos de proteínas e peptídeos, os pacientes podem desenvolver anticorpos anti-exenatido após o tratamento com Byetta. Na maioria dos pacientes que desenvolvem anticorpos, os títulos de anticorpos diminuem com o tempo.
Nos ensaios controlados de 30 semanas de adição de Byetta à metformina e / ou sulfonilureia, 38% dos pacientes apresentaram anticorpos anti-exenatido de baixo título em 30 semanas. Para este grupo, o nível de controle glicêmico (HbA1c) foi geralmente comparável ao observado naqueles sem títulos de anticorpos. Um adicional de 6% dos pacientes apresentaram anticorpos com título mais alto em 30 semanas. Em cerca de metade desses 6% (3% do total de pacientes que receberam Byetta nos estudos controlados de 30 semanas), a resposta glicêmica a Byetta foi atenuada; o restante teve uma resposta glicêmica comparável à de pacientes sem anticorpos.
No ensaio de 16 semanas de adição de Byetta às tiazolidinedionas, com ou sem metformina, 9% dos pacientes apresentaram anticorpos mais altos nas 16 semanas. Comparado com pacientes que não desenvolveram anticorpos para Byetta, em média a resposta glicêmica em pacientes com anticorpos com título mais alto foi atenuada.
A resposta glicêmica do paciente a Byetta deve ser monitorada. Se houver piora no controle glicêmico ou falha em atingir o controle glicêmico direcionado, deve-se considerar terapia antidiabética alternativa.
topo
Sobredosagem
Em um estudo clínico de Byetta, três pacientes com diabetes tipo 2 experimentaram uma overdose única de 100 mcg de SC (10 vezes a dose máxima recomendada). Os efeitos das sobredosagens incluíram náusea grave, vômito grave e concentrações de glicose no sangue em rápido declínio. Um dos três pacientes apresentou hipoglicemia grave, necessitando de administração parenteral de glicose. Os três pacientes se recuperaram sem complicações. Em caso de sobredosagem, deve ser iniciado tratamento de suporte adequado, de acordo com os sinais e sintomas clínicos do paciente.
topo
Dosagem e Administração
A terapia com Byetta deve ser iniciada a 5 mcg por dose, administrada duas vezes ao dia a qualquer momento dentro dos 60 minutos período antes das refeições da manhã e da noite (ou antes das duas refeições principais do dia, aproximadamente 6 horas ou mais separados). Byetta não deve ser administrado após uma refeição. Com base na resposta clínica, a dose de Byetta pode ser aumentada para 10 mcg duas vezes ao dia após 1 mês de terapia. Cada dose deve ser administrada como uma injeção de SC na coxa, abdômen ou parte superior do braço.
O Byetta é recomendado para uso em pacientes com diabetes mellitus tipo 2 que já estejam recebendo metformina, sulfonilureia, tiazolidinediona, uma combinação de metformina e uma sulfonilureia, ou uma combinação de metformina e uma tiazolidinediona, e têm níveis abaixo do ideal controle glicêmico. Quando Byetta é adicionado à terapia com metformina ou tiazolidinediona, a dose atual de metformina ou tiazolidinediona pode ser continuada pois é improvável que a dose de metformina ou tiazolidinediona exija ajuste devido à hipoglicemia quando usada com Byetta. Quando o Byetta é adicionado à terapia com sulfonilureia, uma redução na dose de sulfonilureia pode ser considerada para reduzir o risco de hipoglicemia (ver PRECAUÇÕES, Hipoglicemia).
O Byetta é um líquido transparente e incolor e não deve ser utilizado se aparecerem partículas ou se a solução estiver turva ou colorida. Byetta não deve ser usado após a data de validade. Não existem dados disponíveis sobre a segurança ou eficácia da injeção intravenosa ou intramuscular de Byetta.
topo
Armazenamento
Antes da primeira utilização, o Byetta deve ser armazenado refrigerado entre 2 ° C e 8 ° C. Após o primeiro uso, o Byetta pode ser mantido a uma temperatura que não exceda 25 ° C (77 ° F). Não congele. Não use o Byetta se estiver congelado. Byetta deve ser protegido da luz. A caneta deve ser descartada 30 dias após o primeiro uso, mesmo se algum medicamento permanecer na caneta.
topo
Como é Fornecido
O Byetta é fornecido como uma solução estéril para injeção subcutânea contendo 250 mcg / mL de exenatido. Os seguintes pacotes estão disponíveis:
5 mcg por dose, 60 doses, 1,2 ml de caneta pré-cheia NDC 66780-210-07
10 mcg por dose, 60 doses, 2,4 ml de caneta pré-cheia NDC 66780-210-08
SOMENTE Rx
Fabricado para Amylin Pharmaceuticals, Inc., San Diego, CA 92121
Comercializado pela Amylin Pharmaceuticals, Inc. e Eli Lilly and Company
1-800-868-1190
http://www.Byetta.com
Byetta é uma marca registrada da Amylin Pharmaceuticals, Inc.
© 2007 Amylin Pharmaceuticals, Inc. Todos os direitos reservados.
última atualização 09/2007
Byetta (Exenatide) Informações do Paciente (Em inglês simples)
Informações detalhadas sobre sinais, sintomas, causas, tratamentos da diabetes
As informações desta monografia não se destinam a cobrir todos os usos possíveis, instruções, precauções, interações medicamentosas ou efeitos adversos. Esta informação é generalizada e não se destina a aconselhamento médico específico. Se você tiver dúvidas sobre os medicamentos que está tomando ou quiser obter mais informações, consulte seu médico, farmacêutico ou enfermeiro.
de volta a: Procurar todos os medicamentos para diabetes



