Nuvigil: Tratamento excessivo da sonolência (informações completas sobre prescrição)
Marca: Nuvigil
Nome genérico: armodafinil
Comprimidos Nuvigil® (armodafinil) [C-IV]
O armodafinil é um medicamento que promove a vigília disponível como o Nuvigil usado para tratar apneia do sono, narcolepsia ou distúrbio do sono no trabalho por turnos. Uso, dosagem, efeitos colaterais.
Conteúdo:
Descrição
Farmacologia Clínica
Testes clínicos
Indicações e uso
Contra-indicações
Advertências
Precauções
Reações adversas
Abuso e dependência de drogas
Overdose
Dosagem e Administração
Como fornecido
Ficha de informações do paciente Nuvigil (Em inglês simples)
Descrição
NUVIGIL® (armodafinil) é um agente promotor da vigília para administração oral. O armodafinil é o enantiómero R do modafinil, que é uma mistura dos enantiómeros R e S. O nome químico do armodafinil é 2 - [(R) - (difenilmetil) sulfinil] acetamida. A fórmula molecular é C15H15NÃO2S e o peso molecular é de 273,35.
A estrutura química é:
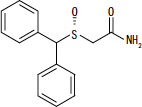
O armodafinil é um pó cristalino branco a esbranquiçado que é levemente solúvel em água, moderadamente solúvel em acetona e solúvel em metanol. Os comprimidos de NUVIGIL contêm 50, 150 ou 250 mg de armodafinil e os seguintes ingredientes inativos: croscarmelose sódio, lactose monohidratada, estearato de magnésio, celulose microcristalina, povidona e pré-gelatinizada amido.
topo
Farmacologia Clínica
Mecanismo de Ação e Farmacologia
O (s) mecanismo (s) preciso (s) através do qual o armodafinil (enantiómero R) ou modafinil (mistura de enantiómeros R e S) promove a vigília é desconhecido. Tanto o armodafinil como o modafinil mostraram propriedades farmacológicas semelhantes em estudos não clínicos em animais e in vitro, na medida testada.
continuar a história abaixo
Em concentrações farmacologicamente relevantes, o armodafinil não se liga ou inibe vários receptores e enzimas potencialmente relevantes para a regulação do sono / vigília, incluindo aqueles para serotonina, dopamina, adenosina, galanina, melatonina, melanocortina, orexin-1, orphanin, PACAP ou benzodiazepínicos ou transportadores de GABA, serotonina, norepinefrina e colina ou fosfodiesterase VI, COMT, GABA transaminase e tirosina hidroxilase. O modafinil não inibe a atividade da MAO-B ou das fosfodiesterases II-IV.
A vigília induzida por modafinil pode ser atenuada pelo antagonista do receptor a-adrenérgico, prazosina; no entanto, o modafinil é inativo em outros sistemas de ensaio in vitro conhecidos por serem responsivos a agonistas a-adrenérgicos, como a preparação de ducto deferente de rato.
O armodafinil não é um agonista do receptor de dopamina de ação direta ou indireta. No entanto, in vitro, o armodafinil e o modafinil se ligam ao transportador de dopamina e inibem a recaptação da dopamina. Para o modafinil, essa atividade tem sido associada in vivo ao aumento dos níveis de dopamina extracelular em algumas regiões cerebrais dos animais. Em camundongos geneticamente modificados sem o transportador de dopamina (DAT), o modafinil não possuía atividade promotora de vigília, sugerindo que essa atividade era dependente do DAT. No entanto, os efeitos promotores da vigília do modafinil, diferentemente dos da anfetamina, não foram antagonizados pelo antagonista do receptor da dopamina haloperidol em ratos.
Além disso, a alfa-metil-p-tirosina, um inibidor da síntese de dopamina, bloqueia a ação da anfetamina, mas não bloqueia a atividade locomotora induzida pelo modafinil.
O armodafinil e o modafinil têm ações promotoras de vigília semelhantes aos agentes simpatomiméticos, incluindo anfetamina e metilfenidato, embora seu perfil farmacológico não seja idêntico ao dos simpatomiméticos aminas. Além de seus efeitos promotores de vigília e capacidade de aumentar a atividade locomotora em animais, o modafinil produz efeitos psicoativos e eufóricos, alterações de humor, percepção, pensamento e sentimentos típicos de outros estimulantes do SNC em humanos. O modafinil possui propriedades reforçadoras, como evidenciado por sua autoadministração em macacos previamente treinados para autoadministrar cocaína; o modafinil também foi parcialmente discriminado como estimulante.
Com base em estudos não clínicos, dois metabólitos principais, ácido e sulfona, de modafinil ou armodafinil, não parecem contribuir para as propriedades ativadoras do SNC dos compostos progenitores.
Farmacocinética
O componente ativo do NUVIGIL é o armodafinil, que é o enantiômero de vida mais longa do modafinil. O NUVIGIL exibe uma cinética linear independente do tempo, após administração de doses orais única e múltipla. O aumento da exposição sistêmica é proporcional no intervalo de doses de 50 a 400 mg. Não foi observada alteração na cinética dependente do tempo durante 12 semanas de administração. O estado estacionário aparente de NUVIGIL foi atingido no prazo de 7 dias após a administração. No estado estacionário, a exposição sistêmica ao NUVIGIL é 1,8 vezes a exposição observada após uma dose única. Os perfis de concentração-tempo do enantiómero R puro após administração de 50 mg de NUVIGIL ou 100 mg de PROVIGIL® (modafinil) são quase sobrepostas.
Absorção
NUVIGIL é facilmente absorvido após administração oral. A biodisponibilidade oral absoluta não foi determinada devido à insolubilidade aquosa do armodafinil, que impedia a administração intravenosa. As concentrações plasmáticas máximas são atingidas aproximadamente 2 horas no estado de jejum. O efeito dos alimentos na biodisponibilidade geral do NUVIGIL é considerado mínimo; no entanto, tempo para atingir o pico de concentração (tmax) pode demorar cerca de 2-4 horas no estado alimentado. Desde o atraso em tmax Como também está associado a níveis plasmáticos elevados mais tarde, os alimentos podem afetar potencialmente o início e o curso da ação farmacológica do NUVIGIL.
Distribuição
NUVIGIL tem um volume aparente de distribuição de aproximadamente 42 L. Dados específicos para a ligação à proteína armodafinil não estão disponíveis. No entanto, o modafinil está moderadamente ligado às proteínas plasmáticas (aproximadamente 60%), principalmente à albumina. O potencial de interações de NUVIGIL com drogas altamente ligadas a proteínas é considerado mínimo.
Metabolismo
Dados in vitro e in vivo mostram que o armodafinil sofre desamidação hidrolítica, oxidação S e hidroxilação de anel aromático, com subsequente conjugação de glucuronídeo dos produtos hidroxilados. A hidrólise de amida é a via metabólica mais proeminente, com a formação de sulfona pelo citocromo P450 (CYP) 3A4 / 5 sendo a próxima em importância. Os outros produtos oxidativos são formados muito lentamente in vitro para permitir a identificação da (s) enzima (s) responsável (s). Apenas dois metabolitos atingem concentrações apreciáveis no plasma (isto é, ácido R-modafinil e modafinil sulfona).
Dados específicos para a disposição NUVIGIL não estão disponíveis. Contudo, o modafinil é principalmente eliminado através do metabolismo, predominantemente no fígado, com menos de 10% do composto original excretado na urina. Um total de 81% da radioatividade administrada foi recuperada 11 dias após a dose, predominantemente na urina (80% vs 1,0% nas fezes).
Eliminação
Após administração oral de NUVIGIL, o armodafinil exibe um aparente declínio monoexponencial a partir da concentração plasmática máxima. O terminal aparente t ½ é de aproximadamente 15 horas. A depuração oral do NUVIGIL é de aproximadamente 33 mL / min.
Interações medicamentosas
A existência de múltiplas vias para o metabolismo do armodafinil, bem como o fato de uma via não relacionada ao CYP ser a mais rápida na metabolização do armodafinil, sugerem que existe uma baixa probabilidade de efeitos substantivos no perfil farmacocinético geral de NUVIGIL devido à inibição da CYP por concomitante medicações.
Dados in vitro demonstraram que o armodafinil mostra uma resposta indutiva fraca para o CYP1A2 e possivelmente para o CYP3A atividades relacionadas à concentração e que a atividade do CYP2C19 é inibida reversivelmente por armodafinil. Outras atividades do CYP não pareciam ser afetadas pelo armodafinil. Um estudo in vitro demonstrou que o armodafinil é um substrato da glicoproteína-P.
A administração crônica de NUVIGIL em 250 mg reduziu a exposição sistêmica ao midazolam em 32% e 17% após administração oral única (5). mg) e doses intravenosas (2 mg), respectivamente, sugerindo que a administração de NUVIGIL induz moderadamente a CYP3A atividade. Drogas que são substratos para o CYP3A4 / 5, como a ciclosporina, podem exigir ajuste da dose. (Vejo Precauções, Interações medicamentosas).
A administração crônica de NUVIGIL em 250 mg não afetou a farmacocinética da cafeína (200 mg), um substrato da sonda para a atividade do CYP1A2.
A administração concomitante de uma dose única de 400 mg de NUVIGIL com omeprazol (40 mg) aumentou a exposição ao omeprazol em aproximadamente 40%, indicando que o armodafinil inibe moderadamente o CYP2C19 atividade. Drogas que são substratos para o CYP2C19 podem exigir redução da dose. (Vejo Precauções, Interações medicamentosas).
Efeito de gênero
A análise farmacocinética da população não sugere efeito de gênero na farmacocinética do armodafinil.
Populações Especiais
Dados específicos para o armodafinil em populações especiais não estão disponíveis.
Efeito da idade: Foi observada uma ligeira diminuição (~ 20%) da depuração oral (CL / F) de modafinil em um estudo de dose única de 200 mg em 12 indivíduos com idade média de 63 anos (intervalo de 53 a 72 anos), mas a alteração foi considerada pouco provável de ser clinicamente significativo. Num estudo de doses múltiplas (300 mg / dia) em 12 doentes com uma idade média de 82 anos (intervalo 67 - 87 anos), a média os níveis de modafinil no plasma foram aproximadamente duas vezes os obtidos historicamente em assuntos. Devido aos efeitos potenciais dos vários medicamentos concomitantes com os quais a maioria dos pacientes estava sendo tratada, a aparente diferença na farmacocinética do modafinil pode não ser atribuída apenas aos efeitos da envelhecimento. No entanto, os resultados sugerem que a depuração do modafinil pode ser reduzida em idosos (ver Dosagem e Administração).
Efeito Raça: A influência da raça na farmacocinética do modafinil não foi estudada.
Insuficiência renal: Num estudo de dose única de 200 mg de modafinil, a insuficiência renal crônica grave (depuração da creatinina <20 mL / min) não influenciar significativamente a farmacocinética do modafinil, mas a exposição ao ácido modafinil aumentou 9 vezes (consulte Precauções).
Insuficiência hepática: A farmacocinética e o metabolismo do modafinil foram examinados em pacientes com cirrose hepática (6 homens e 3 mulheres). Três pacientes apresentaram cirrose em estágio B ou B + e 6 pacientes apresentaram cirrose em estágio C ou C + (de acordo com os critérios do escore de Child-Pugh). Clinicamente 8 dos 9 pacientes eram ictericos e todos tinham ascite. Nestes doentes, a depuração oral de modafinil diminuiu cerca de 60% e a concentração no estado estacionário duplicou em comparação com os doentes normais. A dose de NUVIGIL deve ser reduzida em doentes com compromisso hepático grave (ver Precauções e Dosagem e Administração).
topo
Testes clínicos
A eficácia do NUVIGIL na melhoria da vigília foi estabelecida no sono a seguir. distúrbios: síndrome da apneia obstrutiva do sono / hipopneia (SAHOS), narcolepsia e distúrbios do sono no trabalho por turnos (SWSD).
Para cada ensaio clínico, foi necessário um valor de p <0,05 para significância estatística.
Síndrome da apneia obstrutiva do sono / hipopneia (SAHOS)
A eficácia do NUVIGIL na melhora da vigília em pacientes com sonolência excessiva associada à SAHOS foi estabelecida em dois estudos de 12 semanas, multicêntricos, controlados por placebo, em grupo paralelo, duplo-cegos de pacientes ambulatoriais que atenderam ao International Critérios de classificação de distúrbios do sono (ICSD) para SAHOS (que também são consistentes com a American Psychiatric Association Critérios do DSM-IV). Esses critérios incluem: 1) sonolência excessiva ou insônia, além de episódios frequentes de deficiência respiração durante o sono e características associadas, como roncos altos, dores de cabeça pela manhã ou boca seca despertar; ou 2) sonolência excessiva ou insônia; e polissonografia demonstrando um dos seguintes: mais de cinco apneias obstrutivas, cada uma com duração superior a 10 segundos, por hora de sono; e um ou mais dos seguintes itens: despertares freqüentes do sono associados às apneias, braditachicardia ou dessaturação do oxigênio arterial em associação com as apneias. Além disso, para a entrada nesses estudos, todos os pacientes precisavam ter sonolência excessiva, como demonstrado com pontuação <10 na escala de sonolência de Epworth, apesar do tratamento com pressão positiva contínua nas vias aéreas (CPAP). Foram necessárias evidências de que o CPAP foi eficaz na redução de episódios de apneia / hipopneia, juntamente com a documentação do uso do CPAP.
Foi exigido que os pacientes aderissem ao CPAP, definido como uso de CPAP> 4 horas / noite em> 70% das noites. O uso do CPAP continuou durante todo o estudo. Em ambos os estudos, as principais medidas de efetividade foram 1) latência do sono, avaliada pelo Teste de Manutenção da Vigília (MWT) e 2) a mudança no estado geral da doença do paciente, medida pela Impressão Clínica Global de Mudança (CGI-C) no final Visita. Para um julgamento bem-sucedido, ambas as medidas tiveram que mostrar uma melhora estatisticamente significativa.
O MWT mede a latência (em minutos) para o início do sono. Um MWT estendido foi realizado com sessões de teste em intervalos de 2 horas entre 9:00 e 19:00. A análise primária foi a média das latências do sono nas quatro primeiras sessões de teste (9h às 15h). Para cada sessão de teste, foi solicitado ao sujeito que tentasse permanecer acordado sem usar medidas extraordinárias. Cada sessão de teste era encerrada após 30 minutos, se não ocorresse sono ou imediatamente após o início do sono. O CGI-C é uma escala de 7 pontos, centrada em nenhuma mudança e variando de muito pior a muito melhor. Os avaliadores não receberam orientação específica sobre os critérios a serem aplicados ao classificar os pacientes.
No primeiro estudo, um total de 395 pacientes com SAHOS foram randomizados para receber NUVIGIL 150 mg / dia, NUVIGIL 250 mg / dia ou placebo correspondente. Os pacientes tratados com NUVIGIL mostraram uma melhora estatisticamente significativa na capacidade de permanecer acordados em comparação com os pacientes tratados com placebo, conforme medido pelo MWT na consulta final. Um número maior estatisticamente significativo de pacientes tratados com NUVIGIL mostrou melhora no estado clínico geral, avaliado pela escala CGI-C na consulta final. As latências médias do sono (em minutos) no MWT na linha de base para os ensaios são mostradas na Tabela 1 abaixo, juntamente com a alteração média da linha de base no MWT na consulta final. As porcentagens de pacientes que apresentaram algum grau de melhora no CGI-C nos ensaios clínicos são mostradas na Tabela 2 abaixo. As duas doses de NUVIGIL produziram efeitos estatisticamente significativos de magnitudes semelhantes no MWT e também no CGI-C.
No segundo estudo, 263 pacientes com SAHOS foram randomizados para NUVIGIL 150 mg / dia ou placebo. Os pacientes tratados com NUVIGIL mostraram uma melhora estatisticamente significativa na capacidade de permanecer acordados em comparação com os pacientes tratados com placebo, conforme medido pelo MWT [Tabela 1]. Um número maior estatisticamente significante de pacientes tratados com NUVIGIL mostrou melhora no quadro clínico geral, avaliado pela escala CGI-C [Tabela 2].
O sono noturno medido com polissonografia não foi afetado pelo uso de NUVIGIL em nenhum dos estudos.
Narcolepsia
Foi estabelecida a eficácia do NUVIGIL na melhora da vigília em pacientes com sonolência excessiva (SE) associada à narcolepsia em um estudo de 12 semanas, multicêntrico, controlado por placebo, em grupo paralelo, duplo-cego de pacientes ambulatoriais que atendiam aos critérios do ICSD para narcolepsia. Um total de 196 pacientes foram randomizados para receber NUVIGIL 150 ou 250 mg / dia, ou placebo. Os critérios do ICSD para a narcolepsia incluem 1) cochilos diurnos recorrentes ou lapsos de sono que ocorrem quase diariamente por pelo menos três meses, mais perda súbita bilateral do tônus muscular postural em associação com emoção intensa (cataplexia) ou 2) uma queixa de excesso sonolência ou fraqueza muscular repentina com características associadas: paralisia do sono, alucinações hipnagógicas, comportamentos automáticos, distúrbios graves episódio de sono; e polissonografia que demonstram um dos seguintes: latência do sono em menos de 10 minutos ou latência do sono em movimento rápido dos olhos (REM) menor que 20 minutos e sono múltiplo Teste de Latência (MSLT) que demonstra uma latência média de sono inferior a 5 minutos e dois ou mais períodos REM de início do sono e nenhum distúrbio médico ou mental é responsável pelo sintomas Para a entrada nesses estudos, todos os pacientes foram obrigados a documentar objetivamente sonolência diurna excessiva, via MSLT com uma latência de sono de 6 minutos ou menos e a ausência de qualquer outro médico ou psiquiátrico ativo clinicamente significativo transtorno. O MSLT, uma avaliação polissonográfica objetiva da capacidade do paciente de adormecer em um ambiente não estimulante, latência medida (em minutos) para o início do sono, em média, durante 4 sessões de teste Intervalos de 2 horas. Para cada sessão de teste, o sujeito era instruído a mentir em silêncio e tentar dormir. Cada sessão de teste foi encerrada após 20 minutos se nenhum sono ocorreu ou imediatamente após o início do sono.
As principais medidas de efetividade foram: 1) latência do sono avaliada pelo Teste de Manutenção da Vigília (MWT) e 2) mudança na doença geral do paciente, conforme medido pela Impressão Clínica Global de Mudança (CGI-C) na visita final (consulte a seção TRIALS CLINICAL, OSAHS acima para obter uma descrição desses medidas). Cada sessão de teste MWT foi encerrada após 20 minutos se não ocorreu sono ou imediatamente após o início do sono neste estudo.
Os pacientes tratados com NUVIGIL mostraram uma capacidade estatisticamente significativamente aprimorada de permanecer acordados no MWT a cada dose em comparação com o placebo na consulta final [Tabela 1]. Um número maior estatisticamente significativo de pacientes tratados com NUVIGIL em cada dose mostrou melhora no estado clínico geral, avaliado pela escala CGI-C na consulta final [Tabela 2].
As duas doses de NUVIGIL produziram efeitos estatisticamente significativos de magnitudes semelhantes no CGI-C. Embora tenha sido observado um efeito estatisticamente significativo no MWT para cada dose, a magnitude do efeito foi maior na dose mais alta.
O sono noturno medido com polissonografia não foi afetado pelo uso de NUVIGIL.
Transtorno do sono por turnos de trabalho (SWSD)
A eficácia do NUVIGIL na melhora da vigília em pacientes com sonolência excessiva associada a O SWSD foi demonstrado em um estudo clínico de 12 semanas, multicêntrico, duplo-cego, controlado por placebo, de grupo paralelo tentativas. Um total de 254 pacientes com SWSD crônico foram randomizados para receber NUVIGIL 150 mg / dia ou placebo. Todos os pacientes atenderam aos critérios do ICSD para SWSD crônico [que são consistentes com os critérios do DSM-IV da American Psychiatric Association para Transtorno do Sono com Ritmo Circadiano: Turno de Trabalho]. Esses critérios incluem 1): a) uma queixa primária de sonolência excessiva ou insônia que está temporariamente associada a um período de trabalho (geralmente trabalho noturno) que ocorre durante a fase habitual do sono, ou b) a polissonografia e o MSLT demonstram perda de um padrão normal de vigília do sono (isto é, distúrbios cronobiológicos ritmicidade); e 2) nenhum outro distúrbio médico ou mental é responsável pelos sintomas e 3) os sintomas não atendem aos critérios para qualquer outro distúrbio do sono que produz insônia ou sonolência excessiva (por exemplo, alteração de fuso horário [jet lag] síndrome).
Note-se que nem todos os pacientes com queixa de sonolência que também estão envolvidos em turnos de trabalho atendem aos critérios para o diagnóstico de SWSD. No ensaio clínico, apenas pacientes sintomáticos por pelo menos três meses foram incluídos.
Os pacientes matriculados também eram obrigados a trabalhar no mínimo 5 turnos noturnos por mês, ter sonolência excessiva no horário do turno da noite (pontuação no MSLT <6 minutos) e apresentar insônia diurna documentada por um polissonógrafo diurno (PSG).
As principais medidas de efetividade foram: 1) latência do sono, avaliada pelo Teste de Latência do Sono Múltiplo (MSLT), realizado durante um turno noturno simulado em a visita final e 2) a mudança no status geral da doença do paciente, conforme medido pela Impressão Clínica Global de Mudança (CGI-C) na visita final. (Vejo Testes clínicos, Narcolepsia e SAHOS acima para descrição dessas medidas).
Os pacientes tratados com NUVIGIL mostraram um prolongamento estatisticamente significativo no tempo para dormir início em comparação com pacientes tratados com placebo, conforme medido pelo MSLT noturno na consulta final [Tabela 1]. Um número maior estatisticamente significativo de pacientes tratados com NUVIGIL mostrou melhora no estado clínico geral, avaliado pela escala CGI-C na consulta final [Tabela 2].
O sono diurno medido com polissonografia não foi afetado pelo uso de NUVIGIL.
| Transtorno | A medida | Nuvigil 150 mg * |
Nuvigil 250 mg * |
Placebo | |||
* Significativamente diferente do placebo para todos os ensaios (p <0,05) | |||||||
| Linha de base | mudança da linha de base |
Linha de base | mudança da linha de base |
Linha de base | Alterar de Linha de base |
||
| OSAHS I | MWT | 21.5 | 1.7 | 23.3 | 2.2 | 23.2 | -1.7 |
| OSAHS II | MWT | 23.7 | 2.3 | - | - | 23.3 | -1.3 |
| Narcolepsia | MWT | 12.1 | 1.3 | 9.5 | 2.6 | 12.5 | -1.9 |
| SWSD | MSLT | 2.3 | 3.1 | - | - | 2.4 | 0.4 |
| Transtorno | Nuvigil 150 mg * |
Nuvigil 250 mg * |
Placebo |
* Significativamente diferente do placebo para todos os ensaios (p <0,05) | |||
| OSAHS I | 71% | 74% | 37% |
| OSAHS II | 71% | - | 53% |
| Narcolepsia | 69% | 73% | 33% |
| SWSD | 79% | - | 59% |
topo
Indicações e uso
NUVIGIL é indicado para melhorar a vigília em pacientes com sonolência excessiva associada à síndrome da apneia obstrutiva do sono / hipopneia, narcolepsia e distúrbios do sono no trabalho por turnos.
Na SAHOS, NUVIGIL é indicado como um complemento do (s) tratamento (s) padrão (s) para a obstrução subjacente. Se a pressão positiva contínua nas vias aéreas (CPAP) for o tratamento de escolha para um paciente, um esforço máximo para tratar com CPAP por um período de tempo adequado deve ser feito antes do início do NUVIGIL. Se o NUVIGIL for usado em conjunto com o CPAP, é necessário incentivar e avaliar periodicamente a conformidade com o CPAP.
Em todos os casos, é de extrema importância uma atenção cuidadosa ao diagnóstico e tratamento dos distúrbios do sono subjacentes. Os prescritores devem estar cientes de que alguns pacientes podem ter mais de um distúrbio do sono, contribuindo para a sonolência excessiva.
A eficácia do NUVIGIL no uso a longo prazo (superior a 12 semanas) não foi avaliada sistematicamente em estudos controlados por placebo. O médico que optar por prescrever NUVIGIL por um período prolongado em pacientes deve reavaliar periodicamente a utilidade a longo prazo para cada paciente.
topo
Contra-indicações
NUVIGIL está contra-indicado em pacientes com hipersensibilidade conhecida ao modafinil e armodafinil ou seus ingredientes inativos.
topo
ADVERTÊNCIAS
Erupção cutânea grave, incluindo Síndrome de Stevens-Johnson
Foram notificadas erupções cutâneas graves que requerem hospitalização e descontinuação do tratamento em adultos em associação com o uso de armodafinil e em adultos e crianças em associação com o uso de modafinil, uma mistura racêmica de modafinil S e R (este último é armodafinil).
O armodafinil não foi estudado em pacientes pediátricos em nenhum cenário e não está aprovado para uso em pacientes pediátricos para qualquer indicação.
Não foram relatadas erupções cutâneas graves em ensaios clínicos em adultos (0 por 1.595) de armodafinil. No entanto, casos de erupção cutânea grave foram relatados em adultos na experiência pós-comercialização. Como o armodafinil é o isômero R do modafinil racêmico, um risco semelhante de erupção cutânea grave em pacientes pediátricos com armodafinil não pode ser descartado.
Nos ensaios clínicos de modafinil (o racemato), a incidência de erupção cutânea resultando em descontinuação foi de aproximadamente 0,8% (13 por 1.585) em pacientes pediátricos (idade <17 anos); essas erupções cutâneas incluíram 1 caso de possível síndrome de Stevens-Johnson (SJS) e 1 caso de reação aparente de hipersensibilidade de múltiplos órgãos. Vários dos casos foram associados a febre e outras anormalidades (por exemplo, vômitos, leucopenia). O tempo médio para erupção cutânea que resultou na descontinuação foi de 13 dias. Nenhum desses casos foi observado entre 380 pacientes pediátricos que receberam placebo. Não foram relatadas erupções cutâneas graves em ensaios clínicos em adultos (0 por 4.264) de modafinil. Casos raros de erupção cutânea grave ou com risco de vida, incluindo SJS, necrólise epidérmica tóxica (NET) e erupção cutânea com Eosinofilia e sintomas sistêmicos (DRESS) foram relatados em adultos e crianças na experiência pós-comercialização mundial com modafinil. A taxa de notificação de RTE e SJS associada ao uso de modafinil, geralmente aceita como subestimada por subnotificação, excede a taxa de incidência de fundo. As estimativas da taxa de incidência de fundo para essas reações cutâneas graves na população em geral variam de 1 a 2 casos por milhão de pessoas / ano.
Sabe-se que não há fatores que prevejam o risco de ocorrência ou a gravidade da erupção cutânea associada ao armodafinil ou modafinil. Quase todos os casos de erupção cutânea grave associados ao armodafinil ou modafinil ocorreram dentro de 1 a 5 semanas após o início do tratamento. No entanto, casos isolados foram relatados após tratamento prolongado com modafinil (por exemplo, 3 meses). Consequentemente, não se pode confiar na duração da terapia como um meio de prever o risco potencial anunciado pela primeira aparição de uma erupção cutânea.
Embora as erupções cutâneas benignas também ocorram com o armodafinil, não é possível prever com segurança quais erupções cutâneas serão graves. Consequentemente, o armodafinil deve normalmente ser descontinuado ao primeiro sinal de erupção cutânea, a menos que a erupção cutânea não esteja claramente relacionada à droga. A interrupção do tratamento pode não impedir que uma erupção cutânea se torne ameaçadora à vida ou permanentemente desabilitando ou desfigurando.
Angioedema e reações anafilactóides
Um caso grave de angioedema e um caso de hipersensibilidade (com erupção cutânea, disfagia e broncoespasmo) foram observados entre 1.595 pacientes tratados com armodafinil. Os pacientes devem ser aconselhados a interromper o tratamento e relatar imediatamente ao médico quaisquer sinais ou sintomas sugestivos de angioedema ou anafilaxia (por exemplo, inchaço da face, olhos, lábios, língua ou laringe; dificuldade em engolir ou respirar; rouquidão).
Reações de hipersensibilidade de múltiplos órgãos
As reações de hipersensibilidade de múltiplos órgãos, incluindo pelo menos uma fatalidade na experiência pós-comercialização, ocorreu em estreita associação temporal (tempo médio para detecção de 13 dias: intervalo 4-33) ao início da modafinil. Não se pode excluir um risco semelhante de reações de hipersensibilidade de múltiplos órgãos ao armodafinil.
Embora tenha havido um número limitado de relatos, as reações de hipersensibilidade de múltiplos órgãos podem resultar em hospitalização ou com risco de vida. Sabe-se que não há fatores que prevejam o risco de ocorrência ou a gravidade das reações de hipersensibilidade de múltiplos órgãos associadas ao modafinil. Os sinais e sintomas desse distúrbio eram diversos; no entanto, os pacientes geralmente, embora não exclusivamente, apresentavam febre e erupção cutânea associada a outro envolvimento do sistema orgânico. Outras manifestações associadas incluíram miocardite, hepatite, anormalidades nos testes de função hepática, anormalidades hematológicas (por exemplo, eosinofilia, leucopenia, trombocitopenia), prurido e astenia. Como a hipersensibilidade a múltiplos órgãos é variável em sua expressão, outros sintomas e sinais do sistema orgânico, não mencionados aqui, podem ocorrer.
Se houver suspeita de reação de hipersensibilidade a múltiplos órgãos, o NUVIGIL deve ser descontinuado. Embora não haja relatos de casos que indiquem sensibilidade cruzada com outros medicamentos que produzem essa síndrome, a experiência com medicamentos associados à hipersensibilidade de múltiplos órgãos indicaria que este é um possibilidade.
Sonolência persistente
Pacientes com níveis anormais de sonolência que tomam NUVIGIL devem ser avisados de que seu nível de vigília pode não voltar ao normal. Pacientes com sonolência excessiva, incluindo aqueles que tomam NUVIGIL, devem ser frequentemente reavaliados por sonolência e, se apropriado, aconselhados a evitar dirigir ou qualquer outro veículo potencialmente perigoso atividade. Os prescritores também devem estar cientes de que os pacientes podem não reconhecer sonolência ou sonolência até serem questionados diretamente sobre sonolência ou sonolência durante atividades específicas.
Sintomas psiquiátricos
Foram relatadas experiências adversas psiquiátricas em pacientes tratados com modafinil. Modafinil e armodafinil (NUVIGIL) estão intimamente relacionados. Portanto, espera-se que a incidência e o tipo de sintomas psiquiátricos associados ao armodafinil sejam semelhantes à incidência e ao tipo desses eventos com o modafinil.
Os eventos adversos pós-comercialização associados ao uso de modafinil incluem mania, delírios, alucinações, ideação suicida e agressão, alguns resultando em hospitalização. Muitos, mas não todos, os pacientes tinham uma história psiquiátrica anterior. Um voluntário saudável do sexo masculino desenvolveu idéias de referência, delírios paranóicos e alucinações auditivas em associação com múltiplas doses diárias de 600 mg de modafinil e privação do sono. Não houve evidência de psicose 36 horas após a descontinuação do medicamento.
No banco de dados do estudo controlado NUVIGIL, ansiedade, agitação, nervosismo e irritabilidade foram razões para descontinuação do tratamento mais frequentemente em doentes a tomar NUVIGIL em comparação com placebo (NUVIGIL 1,2% e placebo 0.3%). Nos estudos controlados pelo NUVIGIL, a depressão também foi um motivo para a descontinuação do tratamento com mais frequência em pacientes em uso do NUVIGIL em comparação ao placebo (NUVIGIL 0,6% e placebo 0,2%). Dois casos de ideação suicida foram observados em ensaios clínicos. Deve-se tomar cuidado quando NUVIGIL é administrado a pacientes com histórico de psicose, depressão ou mania. Se os sintomas psiquiátricos se desenvolverem em associação com a administração de NUVIGIL, considere interromper o uso do NUVIGIL.
topo
PRECAUÇÕES
Diagnóstico de Distúrbios do Sono
NUVIGIL deve ser utilizado apenas em pacientes que tiveram uma avaliação completa de sua sonolência excessiva e nos quais um diagnóstico de narcolepsia, SAHOS e / ou SWSD foi feito de acordo com os critérios de diagnóstico ICSD ou DSM (consulte Testes clínicos). Essa avaliação geralmente consiste em uma história completa e exame físico, e pode ser complementada com testes em laboratório. Alguns pacientes podem ter mais de um distúrbio do sono, contribuindo para sua sonolência excessiva (por exemplo, SAHOS e SWSD coincidentes no mesmo paciente).
Uso de CPAP em pacientes com SAHOS
Na SAHOS, NUVIGIL é indicado como um complemento do (s) tratamento (s) padrão (s) para a obstrução subjacente. Se a pressão positiva contínua nas vias aéreas (CPAP) for o tratamento de escolha para um paciente, um esforço máximo para tratar com CPAP por um período de tempo adequado deve ser feito antes do início do NUVIGIL. Se o NUVIGIL for usado em conjunto com o CPAP, é necessário incentivar e avaliar periodicamente a conformidade com o CPAP. Houve uma ligeira tendência para redução do uso de CPAP ao longo do tempo (redução média de 18 minutos para pacientes tratados com NUVIGIL e uma redução de 6 minutos para pacientes tratados com placebo, com uma média de uso inicial de 6,9 horas por noite) em NUVIGIL ensaios.
Geral
Embora o NUVIGIL não demonstre produzir comprometimento funcional, qualquer medicamento que afete o SNC pode alterar o julgamento, o pensamento ou as habilidades motoras. Os pacientes devem ser alertados sobre a operação de um automóvel ou outra maquinaria perigosa até que sejam razoavelmente certo de que a terapia com NUVIGIL não afetará adversamente sua capacidade de se envolver em tais Atividades.
Sistema cardiovascular
O NUVIGIL não foi avaliado ou utilizado em qualquer extensão apreciável em pacientes com história recente de infarto do miocárdio ou angina instável, e esses pacientes devem ser tratados com cautela.
Nos estudos clínicos de PROVIGIL, sinais e sintomas, incluindo dor no peito, palpitações, dispnéia e isquemia transitória Alterações da onda T no ECG foram observadas em três indivíduos em associação com prolapso da válvula mitral ou ventrículo esquerdo hipertrofia. Recomenda-se que os comprimidos NUVIGIL não sejam utilizados em doentes com história de hipertrofia ventricular esquerda ou em pacientes com prolapso da válvula mitral que sofreram a síndrome do prolapso da válvula mitral ao receberem anteriormente o SNC estimulantes. Os sinais da síndrome do prolapso da válvula mitral incluem, entre outros, alterações isquêmicas no ECG, dor no peito ou arritmia. Se ocorrer um novo aparecimento de algum desses sintomas, considere a avaliação cardíaca.
A monitorização da pressão arterial em ensaios controlados a curto prazo (<3 meses) mostrou apenas pequenos aumentos médios na pressão sistólica e pressão arterial diastólica em pacientes recebendo NUVIGIL em comparação ao placebo (1,2 a 4,3 mmHg nos vários grupos). Houve também uma proporção um pouco maior de pacientes em uso de NUVIGIL que requerem uso novo ou aumentado de medicamentos anti-hipertensivos (2,9%) em comparação com pacientes em uso de placebo (1,8%). O aumento da monitorização da pressão arterial pode ser apropriado em doentes a tomar NUVIGIL.
Pacientes que usam contraceptivos esteroidais
A eficácia dos contraceptivos esteróides pode ser reduzida quando usado com NUVIGIL e por um mês após a descontinuação do tratamento (ver Precauções, Interações medicamentosas). Métodos contraceptivos alternativos ou concomitantes são recomendados para pacientes tratados com NUVIGIL e por um mês após a descontinuação do tratamento com NUVIGIL.
Pacientes em uso de ciclosporina
Os níveis sanguíneos de ciclosporina podem ser reduzidos quando usados com NUVIGIL (ver Precauções, Interações medicamentosas). O monitoramento das concentrações circulantes de ciclosporina e o ajuste posológico adequado da ciclosporina devem ser considerados quando esses medicamentos são utilizados concomitantemente.
Pacientes com comprometimento hepático grave
Em doentes com compromisso hepático grave, com ou sem cirrose (ver Farmacologia Clínica), NUVIGIL deve ser administrado em dose reduzida (ver Dosagem e Administração).
Pacientes com insuficiência renal grave
Existem informações inadequadas para determinar a segurança e a eficácia da dosagem em pacientes com insuficiência renal grave (Para farmacocinética da insuficiência renal, consulte Farmacologia Clínica).
Pacientes idosos
Em doentes idosos, a eliminação do armodafinil e dos seus metabolitos pode ser reduzida em consequência do envelhecimento. Portanto, deve-se considerar o uso de doses mais baixas nessa população (ver Farmacologia Clínica e Dosagem e Administração).
Informação para Pacientes
Os médicos são aconselhados a discutir os seguintes problemas com pacientes para os quais prescrevem NUVIGIL.
NUVIGIL é indicado para pacientes que apresentam níveis anormais de sonolência. NUVIGIL demonstrou melhorar, mas não eliminar, essa tendência anormal de adormecer. Portanto, os pacientes não devem alterar seu comportamento anterior em relação a atividades potencialmente perigosas (por exemplo, dirigir, operar máquinas) ou outros actividades que exijam níveis adequados de vigília, até e a menos que se demonstre que o tratamento com NUVIGIL produz níveis de vigília que permitem Atividades. Os pacientes devem ser avisados de que o NUVIGIL não substitui o sono.
Os pacientes devem ser informados de que pode ser crítico que continuem tomando os tratamentos prescritos anteriormente (por exemplo, pacientes com SAHOS que recebem CPAP devem continuar a fazê-lo).
Os pacientes devem ser informados da disponibilidade de um folheto informativo do paciente e devem ser instruídos a ler o folheto antes de tomar NUVIGIL. Consulte Informações do paciente no final desta rotulagem para obter o texto do folheto fornecido para os pacientes.
Os pacientes devem ser aconselhados a contatar seu médico se sentirem erupção cutânea, depressão, ansiedade ou sinais de psicose ou mania.
Gravidez
Os pacientes devem ser aconselhados a notificar seu médico se engravidarem ou pretenderem engravidar durante o tratamento. As pacientes devem ser alertadas quanto ao risco potencial aumentado de gravidez ao usar contraceptivos esteróides (incluindo depósito ou implante contraceptivos) com NUVIGIL e por um mês após a descontinuação do tratamento (ver Carcinogênese, Mutagênese, Comprometimento da Fertilidade e Gravidez).
Enfermagem
Os pacientes devem ser avisados para notificar seu médico se estiverem amamentando.
Medicação concomitante
Os pacientes devem ser aconselhados a informar seu médico se estiverem tomando ou planejam tomar medicamentos prescritos ou vendidos sem receita, devido ao potencial de interações entre NUVIGIL e outras drogas.
Álcool
Os pacientes devem ser avisados de que o uso de NUVIGIL em combinação com álcool não foi estudado. Os doentes devem ser informados de que é prudente evitar o álcool enquanto estiver a tomar NUVIGIL.
Reações alérgicas
Os doentes devem ser aconselhados a parar de tomar NUVIGIL e a notificar o seu médico se desenvolverem uma erupção cutânea, urticária, feridas na boca, bolhas, descamação da pele, dificuldade em engolir ou respirar ou um alérgico relacionado fenômeno.
Interações medicamentosas
Interações potenciais com drogas que inibem, induzem ou são metabolizadas pelas isoenzimas do citocromo P450 e outras enzimas hepáticas
Devido ao envolvimento parcial das enzimas CYP3A na eliminação metabólica do armodafinil, a co-administração de potentes indutores do CYP3A4 / 5 (por exemplo, carbamazepina, fenobarbital, rifampicina) ou inibidores do CYP3A4 / 5 (por exemplo, cetoconazol, eritromicina) podem alterar os níveis plasmáticos de armodafinil.
O potencial do NUVIGIL para alterar o metabolismo de outras drogas por indução ou inibição enzimática
Medicamentos metabolizados pelo CYP1A2: Dados in vitro demonstraram que o armodafinil mostra uma resposta indutiva fraca para o CYP1A2 e possivelmente para o CYP3A atividades relacionadas à concentração e demonstrou que a atividade do CYP2C19 é inibida reversivelmente por armodafinil. Contudo, o efeito na atividade da CYP1A2 não foi observado clinicamente em um estudo de interação realizado com cafeína (consulte Farmacologia Clínica, Farmacocinética, Interações Medicamentosas).
Medicamentos metabolizados pelo CYP3A4 / 5 (por exemplo, ciclosporina, etinilestradiol, midazolam e triazolam): A administração crônica de NUVIGIL resultou em indução moderada da atividade do CYP3A. Portanto, a eficácia dos medicamentos que são substratos para as enzimas CYP3A (por exemplo, ciclosporina, etinil estradiol, midazolam e triazolam) podem ser reduzidos após o início do tratamento concomitante com NUVIGIL. Foi observada uma redução de 32% na exposição sistêmica do midazolam oral após a administração concomitante de armodafinil com midazolam. Pode ser necessário o ajuste da dose (consulte Farmacologia Clínica, Farmacocinética, Interações Medicamentosas). Tais efeitos (concentrações reduzidas) também foram observados na administração concomitante de modafinil com ciclosporina, etinilestradiol e triazolam.
Medicamentos metabolizados pelo CYP2C19 (por exemplo, omeprazol, diazepam, fenitoína e propranolol): A administração de NUVIGIL resultou em inibição moderada da atividade do CYP2C19. Portanto, a redução da dose pode ser necessária para alguns medicamentos que são substratos para o CYP2C19 (por exemplo, fenitoína, diazepam e propranolol, omeprazol e clomipramina) quando usados simultaneamente com NUVIGIL. Foi observado um aumento de 40% na exposição após a administração concomitante de armodafinil com omeprazol. (Vejo Farmacologia Clínica, Farmacocinética, Interações Medicamentosas).
Interações com o CNS ADrogas ativas
Dados específicos para o potencial de interação medicamentosa do armodafinil com medicamentos ativos no SNC não estão disponíveis. No entanto, as seguintes informações disponíveis sobre interação medicamentosa sobre modafinil devem ser aplicáveis ao armodafinil (consulte Descrição e Farmacologia Clínica).
A administração concomitante de modafinil com metilfenidato ou dextroanfetamina não produziu alterações significativas no perfil farmacocinético do modafinil ou de qualquer estimulante, embora a absorção do modafinil tenha sido atrasada por aproximadamente um hora.
Modafinil ou clomipramina concomitantes não alteraram o perfil PK de nenhum dos medicamentos; no entanto, um incidente de aumento dos níveis de clomipramina e seu metabólito ativo desmetilclomipramina foi relatado em um paciente com narcolepsia durante o tratamento com modafinil.
Dados específicos para o potencial de interação fármaco armodafinil ou modafinil com inibidores da Monoamina Oxidase (MAO) não estão disponíveis. Portanto, deve-se ter cuidado ao administrar concomitantemente inibidores da MAO e NUVIGIL.
Interações com outras drogas
Dados específicos para o potencial de interação medicamentosa do armodafinil para outros medicamentos adicionais não estão disponíveis. No entanto, as seguintes informações disponíveis sobre interação medicamentosa sobre modafinil devem ser aplicáveis ao armodafinil.
Varfarina - A administração concomitante de modafinil com varfarina não produziu alterações significativas nos perfis farmacocinéticos da varfarina R e S. No entanto, como apenas uma dose única de varfarina foi testada neste estudo, uma interação farmacodinâmica não pode ser descartada. Por conseguinte, deve ser considerada uma monitorização mais frequente dos tempos de protrombina / INR sempre que o NUVIGIL é co-administrado com varfarina.
Carcinogênese, mutagênese, comprometimento da fertilidade
Carcinogênese
Não foram realizados estudos de carcinogenicidade apenas com o armodafinil. Foram realizados estudos de carcinogenicidade nos quais o modafinil foi administrado na dieta a camundongos por 78 semanas e a ratos por 104 semanas nas doses de 6, 30 e 60 mg / kg / dia. A dose mais alta estudada representa 1,5 (camundongo) ou 3 (rato) vezes maior que a dose diária recomendada para adultos de modafinil (200 mg) em humanos, em mg / m2. Não houve evidência de tumorigênese associada à administração de modafinil nesses estudos. No entanto, como o estudo em camundongos utilizou uma dose alta inadequada que não era representativa de uma dose máxima tolerada, um estudo de carcinogenicidade subsequente foi realizado na Tg. Camundongo transgênico AC. Doses avaliadas na Tg. O ensaio AC foi de 125, 250 e 500 mg / kg / dia, administrado por via dérmica. Não houve evidência de tumorigenicidade associada à administração de modafinil; no entanto, esse modelo dérmico pode não avaliar adequadamente o potencial carcinogênico de um medicamento administrado por via oral.
Mutagênese
O armodafinil foi avaliado em um ensaio de mutação reversa bacteriana in vitro e em um ensaio de aberração cromossômica de mamífero in vitro em linfócitos humanos. O armodafinil foi negativo nesses ensaios, tanto na ausência quanto na presença de ativação metabólica.
O modafinil não demonstrou evidência de potencial mutagênico ou clastogênico em uma série de testes in vitro (isto é, ensaio de mutação bacteriana reversa, ensaio de linfoma de rato tk, aberração cromossômica) ensaio em linfócitos humanos, ensaio de transformação celular em células embrionárias de camundongos BALB / 3T3) na ausência ou presença de ativação metabólica ou in vivo (micronúcleo de medula óssea de camundongo) ensaios. O modafinil também foi negativo no ensaio de síntese de DNA não programada em hepatócitos de ratos.
Comprometimento da fertilidade
Não foram realizados estudos de fertilidade e desenvolvimento embrionário precoce (para implantação) apenas com o armodafinil.
Administração oral de modafinil (doses de até 480 mg / kg / dia) em ratos machos e fêmeas antes e durante a acasalamento e continuação em fêmeas até o dia 7 da gestação produziu um aumento no tempo de acasalamento dose; não foram observados efeitos em outros parâmetros de fertilidade ou reprodutivos. A dose sem efeito de 240 mg / kg / dia foi associada a uma exposição plasmática ao modafinil (AUC) aproximadamente igual à dos seres humanos na dose recomendada de 200 mg.
Gravidez
Categoria C. da gravidez
Nos estudos realizados em ratos (armodafinil, modafinil) e coelhos (modafinil), observou-se toxicidade no desenvolvimento em exposições clinicamente relevantes.
A administração oral de armodafinil (60, 200 ou 600 mg / kg / dia) em ratas prenhes durante todo o período de organogênese resultou em aumento incidências de variações viscerais e esqueléticas fetais na dose intermediária ou mais e pesos corporais fetais diminuídos nos níveis mais altos dose. A dose sem efeito para a toxicidade do desenvolvimento embrionário de ratos foi associada a um armodafinil plasmático exposição (AUC) aproximadamente 0,03 vezes a AUC em humanos na dose diária máxima recomendada de 250 mg.
O modafinil (50, 100 ou 200 mg / kg / dia) administrado por via oral a ratas prenhes durante todo o período de organogênese causado, na ausência de toxicidade materna, aumento das reabsorções e aumento da incidência de variações viscerais e esqueléticas na prole nos níveis mais altos dose. A dose sem efeito mais alta para a toxicidade embrionária do desenvolvimento de ratos foi associada a um plasma exposição ao modafinil aproximadamente 0,5 vezes a AUC em humanos na dose diária recomendada (RHD) de 200 mg. Contudo, num estudo subsequente de até 480 mg / kg / dia (exposição plasmática ao modafinil aproximadamente 2 vezes a AUC em humanos na RHD), não foram observados efeitos adversos no desenvolvimento embrio-fetal.
Modafinil administrado por via oral a coelhos prenhes durante o período de organogênese em doses de até 100 mg / kg / dia (AUC plasmática de modafinil aproximadamente igual à AUC em humanos na RHD) não teve efeito sobre os embriões fetais. desenvolvimento; no entanto, as doses utilizadas foram muito baixas para avaliar adequadamente os efeitos do modafinil no desenvolvimento embrio-fetal. Num estudo de toxicidade para o desenvolvimento subsequente, avaliando doses de 45, 90 e 180 mg / kg / dia em gestantes coelhos, as incidências de alterações estruturais fetais e morte embrio-fetal foram aumentadas dose. A dose mais alta sem efeitos para a toxicidade do desenvolvimento foi associada a uma AUC plasmática de modafinil aproximadamente igual à AUC em humanos no RHD.
A administração de modafinil em ratos durante a gestação e lactação em doses orais de até 200 mg / kg / dia resultou em diminuição viabilidade na prole em doses superiores a 20 mg / kg / dia (AUC plasmática de modafinil aproximadamente 0,1 vezes a AUC em humanos no RHD). Não foram observados efeitos nos parâmetros pós-natais de desenvolvimento e neurocomportamentais na prole sobrevivente.
Não existem estudos adequados e bem controlados de armodafinil ou modafinil em mulheres grávidas. Dois casos de retardo de crescimento intra-uterino e um caso de aborto espontâneo foram relatados em associação com armodafinil e modafinil. Embora a farmacologia do armodafinil não seja idêntica à das aminas simpatomiméticas, ela compartilha algumas propriedades farmacológicas com essa classe. Alguns desses medicamentos têm sido associados a retardo de crescimento intra-uterino e abortos espontâneos. Não se sabe se os casos relatados com armodafinil estão relacionados a medicamentos.
O armodafinil ou modafinil deve ser usado durante a gravidez apenas se o benefício potencial justificar o risco potencial para o feto.
Trabalho e entrega
O efeito do armodafinil no trabalho de parto e parto em humanos não foi sistematicamente investigado.
Mães que amamentam
Não se sabe se o armodafinil ou seus metabólitos são excretados no leite humano. Uma vez que muitos medicamentos são excretados no leite humano, deve-se ter cuidado quando os comprimidos NUVIGIL são administrados a uma mulher que amamenta.
Uso pediátrico
A segurança e a eficácia do uso de armodafinil em indivíduos com menos de 17 anos de idade não foram estabelecidas. Foram observadas erupções cutâneas graves em pacientes pediátricos que receberam modafinil
Uso Geirátrico
A segurança e a eficácia em indivíduos acima de 65 anos não foram estabelecidas.
topo
Reações adversas
O armodafinil foi avaliado quanto à segurança em mais de 1100 pacientes com sonolência excessiva associada a distúrbios primários do sono e vigília. Em ensaios clínicos, NUVIGIL foi geralmente bem tolerado e a maioria das experiências adversas foi leve a moderada.
Nos estudos clínicos controlados por placebo, os eventos adversos mais comumente observados (> 5%) associados ao uso dos NUVIGIL que ocorrem com mais frequência do que nos pacientes tratados com placebo foram dor de cabeça, náusea, tontura e insônia. O perfil de eventos adversos foi semelhante entre os estudos.
Nos ensaios clínicos controlados por placebo, 44 dos 645 pacientes (7%) que receberam NUVIGIL descontinuaram devido a uma experiência adversa em comparação com 16 dos 445 (4%) dos pacientes que receberam placebo. O motivo mais frequente de descontinuação foi dor de cabeça (1%).
Incidência em ensaios controlados
A tabela a seguir (Tabela 3) apresenta as experiências adversas que ocorreram a uma taxa de 1% ou mais e foram mais freqüente em pacientes tratados com NUVIGIL do que em pacientes do grupo placebo nos ensaios clínicos controlados por placebo.
O prescritor deve estar ciente de que as figuras abaixo não podem ser usadas para prever a frequência de experiências adversas no curso da prática médica habitual, onde as características do paciente e outros fatores podem diferir daqueles que ocorrem durante a estudos. Da mesma forma, as frequências citadas não podem ser comparadas diretamente com os valores obtidos de outras investigações clínicas envolvendo diferentes tratamentos, usos ou investigadores. A revisão dessas frequências, no entanto, fornece aos prescritores uma base para estimar a contribuição relativa de fatores medicamentosos e não medicamentosos para a incidência de eventos adversos na população estudada.
| Classe de órgão do sistema Termo preferencial MedDRA |
Nuvigil (Porcentagem, N = 645) |
Placebo (Porcentagem, N = 445) |
ª Quatro estudos clínicos duplo-cegos, controlados por placebo, em SWSD, SAHOS e narcolepsia; a incidência é arredondada para a porcentagem inteira mais próxima. Incluem-se apenas os eventos para os quais a incidência do Nuvigil é maior que a do placebo. | ||
| Distúrbios cardíacos | ||
| Palpitações | 2 | 1 |
| Problemas gastrointestinais | ||
| Náusea | 7 | 3 |
| Diarréia | 4 | 2 |
| Boca seca | 4 | 1 |
| Dispepsia | 2 | 0 |
| Dor abdominal superior | 2 | 1 |
| Prisão de ventre | 1 | 0 |
| Vômito | 1 | 0 |
| Tamboretes soltos | 1 | 0 |
| Distúrbios gerais e condições do local de administração | ||
| Fadiga | 2 | 1 |
| Sede | 1 | 0 |
| Doença semelhante à gripe | 1 | 0 |
| Dor | 1 | 0 |
| Pirexia | 1 | 0 |
| Distúrbios do sistema imunológico | ||
| Alergia sazonal | 1 | 0 |
| Investigações | ||
| Aumento da gama-glutamiltransferase | 1 | 0 |
| Frequência cardíaca aumentada | 1 | 0 |
| Distúrbios do metabolismo e nutrição | ||
| Anorexia | 1 | 0 |
| Diminuição do apetite | 1 | 0 |
| Distúrbios do sistema nervoso | ||
| Dor de cabeça | 17 | 9 |
| Tontura | 5 | 2 |
| Perturbação na atenção | 1 | 0 |
| Tremor | 1 | 0 |
| Enxaqueca | 1 | 0 |
| Paraesthia | 1 | 0 |
| Distúrbios psiquiátricos | ||
| Insônia | 5 | 1 |
| Ansiedade | 4 | 1 |
| Depressão | 2 | 0 |
| Agitação | 1 | 0 |
| Nervosismo | 1 | 0 |
| Humor deprimido | 1 | 0 |
| Distúrbios renais e urinários | ||
| Poliúria | 1 | 0 |
| Distúrbios respiratórios, torácicos e do mediastino | ||
| Dispnéia | 1 | 0 |
| Distúrbios da pele e tecidos subcutâneos | ||
| Erupção cutânea | 2 | 0 |
| Dermatite de contato | 1 | 0 |
| Hiperidrose | 1 | 0 |
Dependência de dose de eventos adversos
Nos ensaios clínicos controlados por placebo, que compararam doses de 150 mg / dia e 250 mg / dia de Nuvigil e placebo, os únicos eventos adversos que pareciam estar relacionados à dose foram dor de cabeça, erupção cutânea, depressão, boca seca, insônia e náusea.
ª Quatro estudos clínicos duplo-cegos, controlados por placebo, em SWSD, SAHOS e narcolepsia. | ||||
| Classe de órgão do sistema Termo preferencial MedDRA |
Nuvigil 250 mg (Por cento, N = 198) |
Nuvigil 150 mg (Por cento, N = 447) |
Nuvigil Combinado (Por cento, N = 645) |
Placebo (Por cento, N = 445) |
|---|---|---|---|---|
| Problemas gastrointestinais | ||||
| Náusea | 9 | 6 | 7 | 3 |
| Boca seca | 7 | 2 | 4 | <1 |
| Distúrbios do sistema nervoso | ||||
| Dor de cabeça | 23 | 14 | 17 | 9 |
| Distúrbios psiquiátricos | ||||
| Insônia | 6 | 4 | 5 | 1 |
| Depressão | 3 | 1 | 2 | <1 |
| Distúrbios da pele e tecidos subcutâneos | ||||
| Erupção cutânea | 4 | 1 | 2 | <1 |
Alterações nos sinais vitais
Houve pequenos, mas consistentes, aumentos nos valores médios da pressão arterial sistólica e diastólica média em ensaios controlados (ver Precauções). Houve um pequeno, mas consistente, aumento médio na taxa de pulso em relação ao placebo em estudos controlados. Esse aumento variou de 0,9 a 3,5 BPM.
Alterações laboratoriais
Os parâmetros de química clínica, hematologia e análise de urina foram monitorados nos estudos. Os níveis plasmáticos médios de gama glutamiltransferase (GGT) e fosfatase alcalina (AP) foram maiores após a administração de NUVIGIL, mas não o placebo. Poucos indivíduos, no entanto, tiveram elevações de GGT ou AP fora da faixa normal. Não foram aparentes diferenças na alanina aminotransferase, aspartato aminotransferase, proteína total, albumina ou bilirrubina total, embora existam casos raros de elevações isoladas de AST e / ou ALT. Um único caso de pancitopenia leve foi observado após 35 dias de tratamento e resolvido com a descontinuação do medicamento. Uma pequena redução média da linha de base no ácido úrico sérico em comparação com o placebo foi observada em ensaios clínicos. O significado clínico desse achado é desconhecido.
Alterações no ECG
Nenhum padrão de anormalidades no ECG pode ser atribuído à administração de NUVIGIL em ensaios clínicos controlados por placebo.
topo
Abuso e dependência de drogas
Classe de Substância Controlada
O armodafinil (NUVIGIL) é uma substância controlada por programação IV.
Potencial e dependência de abuso
Embora o potencial de abuso do armodafinil não tenha sido estudado especificamente, é provável que seu potencial de abuso seja semelhante ao do modafinil (PROVIGIL). Nos seres humanos, o modafinil produz efeitos psicoativos e eufóricos, alterações de humor, percepção, pensamento e sentimentos típicos de outros estimulantes do SNC. Em estudos de ligação in vitro, o modafinil se liga ao local de recaptação da dopamina e causa um aumento na dopamina extracelular, mas nenhum aumento na liberação da dopamina. O modafinil é reforçador, como evidenciado por sua autoadministração em macacos previamente treinados para autoadministrar cocaína. Em alguns estudos, o modafinil também foi parcialmente discriminado como estimulante. Os médicos devem acompanhar de perto os pacientes, especialmente aqueles com histórico de abuso de drogas e / ou estimulantes (por exemplo, metilfenidato, anfetamina ou cocaína). Os pacientes devem ser observados quanto a sinais de uso indevido ou abuso (por exemplo, aumento de doses ou comportamento de procura de drogas).
O potencial de abuso de modafinil (200, 400 e 800 mg) foi avaliado em relação ao metilfenidato (45 e 90 mg) em um estudo hospitalar em indivíduos com experiência com drogas de abuso. Os resultados deste estudo clínico demonstraram que o modafinil produziu efeitos psicoativos e eufóricos e sentimentos consistentes com outros estimulantes agendados do SNC (metilfenidato).
topo
Overdose
Experiência Humana
Não foram relatadas sobredosagens nos estudos clínicos do NUVIGIL. Os sintomas de sobredosagem com NUVIGIL são provavelmente semelhantes aos do modafinil. A sobredosagem nos ensaios clínicos com modafinil incluiu excitação ou agitação, insônia e elevações leves ou moderadas nos parâmetros hemodinâmicos. Da experiência pós-comercialização com modafinil, não houve relatos de sobredosagens fatais envolvendo apenas modafinil (doses de até 12 gramas). Sobredosagens envolvendo vários medicamentos, incluindo modafinil, resultaram em resultados fatais. Os sintomas que mais frequentemente acompanham a overdose de modafinil, isoladamente ou em combinação com outras drogas, foram incluídos; insônia; sintomas do sistema nervoso central como inquietação, desorientação, confusão, excitação e alucinação; alterações digestivas como náusea e diarréia; e alterações cardiovasculares como taquicardia, bradicardia, hipertensão e dor no peito.
Gerenciamento de Overdose
Não existe antídoto específico para os efeitos tóxicos de uma overdose de NUVIGIL. Tais overdoses devem ser gerenciadas com cuidados de suporte, incluindo monitoramento cardiovascular. Se não houver contra-indicações, deve-se considerar emese induzida ou lavagem gástrica. Não existem dados que sugiram a utilidade da diálise ou acidificação ou alcalinização urinária para melhorar a eliminação do medicamento. O médico deve considerar entrar em contato com um centro de controle de intoxicações para aconselhamento no tratamento de qualquer overdose.
topo
Dosagem e Administração
Síndrome da apneia obstrutiva do sono / hipopneia (SAHOS) e narcolepsia
A dose recomendada de NUVIGIL para pacientes com SAHOS ou narcolepsia é de 150 mg ou 250 mg, administrada em dose única pela manhã. Em pacientes com SAHOS, doses de até 250 mg / dia, administradas em dose única, foram bem toleradas, mas houve Não há evidências consistentes de que esta dose confira benefícios adicionais além da dose de 150 mg / dia (consulte Farmacologia Clínica e Testes clínicos).
Transtorno do sono por turnos de trabalho (SWSD)
A dose recomendada de NUVIGIL para pacientes com SWSD é de 150 mg, administrada diariamente aproximadamente 1 hora antes do início do turno de trabalho.
O ajuste da dose deve ser considerado para medicamentos concomitantes que são substratos para o CYP3A4 / 5, como contraceptivos esteroides, triazolam e ciclosporina (consulte PRECAUÇÕES, Interações Medicamentosas).
Medicamentos amplamente eliminados pelo metabolismo do CYP2C19, como diazepam, propranolol e fenitoína, podem ter eliminação prolongada após a co-administração com NUVIGIL e pode exigir redução da dose e monitoramento da toxicidade (Vejo Precauções, Interações medicamentosas).
Em doentes com compromisso hepático grave, NUVIGIL deve ser administrado a uma dose reduzida (ver Farmacologia Clínica e Precauções).
Existem informações inadequadas para determinar a segurança e eficácia da dosagem em pacientes com insuficiência renal grave (consulte Farmacologia Clínica e Precauções).
Em doentes idosos, a eliminação do armodafinil e dos seus metabolitos pode ser reduzida em consequência do envelhecimento. Portanto, deve-se considerar o uso de doses mais baixas nessa população (ver Farmacologia Clínica e Precauções).
topo
Como Fornecido / Armazenamento e Manuseio
Nuvigil® (armodafinil) Comprimidos [C-IV]
50 mg: Cada comprimido branco a esbranquiçado é gravado com  de um lado e "205" do outro.
de um lado e "205" do outro.
NDC 63459-205-60 - Garrafas de 60
150 mg: Cada comprimido oval branco a esbranquiçado é gravado com  de um lado e "215" do outro.
de um lado e "215" do outro.
NDC 63459-215-60 - Garrafas de 60
250 mg: Cada comprimido oval branco a esbranquiçado é gravado com  de um lado e "225" do outro.
de um lado e "225" do outro.
NDC 63459-225-60 - Garrafas de 60
Armazene a 20 ° - 25 ° C (68 ° - 77 ° F).
Fabricado para:
Cephalon, Inc.
Frazer, PA 19355
última atualização 02/2010
Ficha de informações do paciente Nuvigil (Em inglês simples)
Informações detalhadas sobre Sinais, sintomas, causas, tratamentos de distúrbios do sono
As informações desta monografia não se destinam a cobrir todos os usos possíveis, instruções, precauções, interações medicamentosas ou efeitos adversos. Esta informação é generalizada e não se destina a aconselhamento médico específico. Se você tiver dúvidas sobre os medicamentos que está tomando ou quiser obter mais informações, consulte seu médico, farmacêutico ou enfermeiro.
de volta a:
~ todos os artigos sobre distúrbios do sono



