Namenda: Medicação para Alzheimer
Namenda é um medicamento usado no tratamento da doença de Alzheimer. Informações detalhadas sobre o uso, dosagem, efeitos colaterais de Namenda.
Marca: Namenda
Nome genérico: Cloridrato de memantina
Namenda (cloridrato de memantina) é um medicamento usado no tratamento da doença de Alzheimer. Informações detalhadas sobre os usos, dosagem e efeitos colaterais de Namenda abaixo.
Conteúdo:
Descrição
Farmacologia
Indicações e uso
Contra-indicações
Precauções
Interações medicamentosas
Reações adversas
Overdose
Dosagem
Fornecido
Instruções ao Paciente
Informações do paciente da Namenda (em inglês)
Descrição
O Namenda® (cloridrato de memantina) é um antagonista do receptor NMDA por via oral. O nome químico do cloridrato de memantina é cloridrato de 1-amino-3,5-dimetiladamantano com a seguinte fórmula estrutural:
Fonte: Forest Laboratories, distribuidor dos EUA ou Namenda.
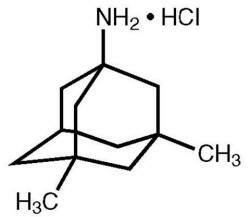
A fórmula molecular é C12H21N · HCl e o peso molecular é 215,76.
O Memantine HCl ocorre como um pó fino branco a esbranquiçado e é solúvel em água. Namenda está disponível em comprimidos ou em solução oral. Namenda está disponível para administração oral como comprimidos revestidos por película, em forma de cápsula, contendo 5 mg e 10 mg de cloridrato de memantina. Os comprimidos também contêm os seguintes ingredientes inativos: celulose microcristalina, lactose monohidratada, dióxido de silício coloidal, talco e estearato de magnésio. Além disso, os seguintes ingredientes inativos também estão presentes como componentes do revestimento do filme: hipromelose, triacetina, dióxido de titânio, FD&C amarelo nº 6 e FD&C azul nº 2 (comprimidos de 5 mg), óxido de ferro preto (comprimidos de 10 mg). A solução oral Namenda contém cloridrato de memantina com uma força equivalente a 2 mg de cloridrato de memantina em cada mL. A solução oral também contém os seguintes ingredientes inativos: solução de sorbitol (70%), metil parabeno, propilparabeno, propileno glicol, glicerina, sabor natural de hortelã-pimenta nº 104, ácido cítrico, citrato de sódio e purificado água.
Farmacologia Clínica
Mecanismo de Ação e Farmacodinâmica
Ativação persistente dos receptores N-metil-D-aspartato do sistema nervoso central (NMDA) Foi sugerido que o glutamato de aminoácido excitatório contribua para a sintomatologia de Doença de Alzheimer. Postula-se que a memantina exerça seu efeito terapêutico através de sua ação como uma afinidade baixa a moderada antagonista não competitivo do receptor NMDA (canal aberto) que se liga preferencialmente ao receptor NMDA operado canais de catação. Não há evidências de que a memantina previna ou diminua a neurodegeneração em pacientes com doença de Alzheimer.
A memantina mostrou uma afinidade baixa a desprezível pelos receptores GABA, benzodiazepina, dopamina, adrenérgica, histamina e glicina e pelos canais Ca 2+, Na + ou K + dependentes de voltagem. A memantina também mostrou efeitos antagônicos no receptor 5HT 3 com potência semelhante à dos receptor NMDA e receptores nicotínicos de acetilcolina bloqueados com um sexto a um décimo do potência.
Estudos in vitro demonstraram que a memantina não afeta a inibição reversível da acetilcolinesterase pelo donepezil, galantamina ou tacrina.
Farmacocinética
A memantina é bem absorvida após administração oral e apresenta farmacocinética linear no intervalo de doses terapêuticas. É excretado predominantemente na urina, inalterado e possui uma meia-vida de eliminação terminal de cerca de 60 a 80 horas.
Absorção e Distribuição
Após administração oral, a memantina é altamente absorvida com concentrações máximas atingidas em cerca de 3-7 horas. Os alimentos não afetam a absorção da memantina. O volume médio de distribuição de memantina é de 9 a 11 L / kg e a ligação às proteínas plasmáticas é baixa (45%).
Metabolismo e Eliminação
A memantina sofre metabolismo hepático parcial. Cerca de 48% da droga administrada é excretada inalterada na urina; o restante é convertido principalmente em três metabólitos polares que possuem um receptor NMDA mínimo atividade antagonista: o conjugado N-glucuronídeo, 6-hidroxi memantina e 1-nitroso-desaminado memantina. Um total de 74% da dose administrada é excretada como a soma do medicamento original e do conjugado N-glucuronido. O sistema enzimático microssômico hepático CYP450 não desempenha um papel significativo no metabolismo da memantina. O Memantine tem uma meia-vida de eliminação terminal de cerca de 60 a 80 horas. A depuração renal envolve secreção tubular ativa moderada por reabsorção tubular dependente de pH.
Populações Especiais
Insuficiência renal: A farmacocinética da memantina foi avaliada após administração oral única de 20 mg de memantina HCl em 8 indivíduos com insuficiência renal leve (depuração da creatinina, CLcr,> 50 - 80 mL / min), 8 indivíduos com insuficiência renal moderada (CLcr 30 - 49 mL / min), 7 indivíduos com insuficiência renal grave (CLcr 5 - 29 mL / min) e 8 indivíduos saudáveis (CLcr> 80 mL / min) corresponderam o mais próximo possível por idade, peso e sexo aos indivíduos com insuficiência renal. imparidade. A AUC média 0- (infinito) aumentou 4%, 60% e 115% em indivíduos com insuficiência renal leve, moderada e grave, respectivamente, em comparação com indivíduos saudáveis. A meia-vida de eliminação terminal aumentou 18%, 41% e 95% em indivíduos com insuficiência renal leve, moderada e grave, respectivamente, em comparação com indivíduos saudáveis.
Nenhum ajuste de dose é recomendado para pacientes com insuficiência renal leve e moderada. A dose deve ser reduzida em pacientes com insuficiência renal grave (consulte DOSAGEM E ADMINISTRAÇÃO).
Idosos: A farmacocinética do Namenda em indivíduos jovens e idosos é semelhante.
Gênero: Após a administração de doses múltiplas de Namenda 20 mg b.i.d., as mulheres tiveram uma exposição cerca de 45% maior do que os homens, mas não houve diferença na exposição quando o peso corporal foi levado em consideração.
Interações medicamentosas
Substratos de enzimas microssomais: Estudos in vitro indicaram que em concentrações superiores às associadas à eficácia, a memantina não induz as isozimas do citocromo P450 CYP1A2, CYP2C9, CYP2E1 e CYP3A4 / 5. Além disso, estudos in vitro demonstraram que a memantina produz inibição mínima das enzimas CYP450 CYP1A2, CYP2A6, CYP2C9, CYP2D6, CYP2E1 e CYP3A4. Esses dados indicam que não são esperadas interações farmacocinéticas com medicamentos metabolizados por essas enzimas.
Inibidores de enzimas microssomais: Como a memantina sofre um metabolismo mínimo, com a maioria da dose excretada inalterada na urina, é improvável uma interação entre a memantina e os medicamentos inibidores das enzimas CYP450. A administração concomitante de Namenda com o inibidor da AChE donepezil HCl não afeta a farmacocinética de nenhum dos compostos.
Medicamentos eliminados por mecanismos renais: A memantina é eliminada em parte pela secreção tubular. Estudos in vivo demonstraram que doses múltiplas de hidroclorotiazida / triamtereno diurético (HCTZ / TA) não afetaram a AUC da memantina no estado estacionário. A memantina não afetou a biodisponibilidade do AT e diminuiu a AUC e a Cmax do HCTZ em cerca de 20%. A administração concomitante de memantina com o medicamento anti-hiperglicêmico Glucovance® (gliburida e metformina HCl) não afetou a farmacocinética da memantina, metformina e gliburida. A memantina não modificou os efeitos séricos de redução da glicose do Glucovance®, indicando a ausência de interação farmacodinâmica.
Medicamentos que tornam a urina alcalina: A depuração da memantina foi reduzida em cerca de 80% em condições de urina alcalina a pH 8. Portanto, alterações do pH da urina em direção ao estado alcalino podem levar ao acúmulo do medicamento, com um possível aumento de efeitos adversos. Espera-se que drogas que alcalinizem a urina (por exemplo, inibidores da anidrase carbônica, bicarbonato de sódio) reduzam a eliminação renal da memantina.
Medicamentos altamente ligados a proteínas plasmáticas: Como a ligação às proteínas plasmáticas da memantina é baixa (45%), é improvável uma interação com drogas altamente ligadas às proteínas plasmáticas, como varfarina e digoxina.
TESTES CLÍNICOS
A eficácia do Namenda (cloridrato de memantina) como tratamento para pacientes com doença de Alzheimer moderada a grave foi demonstrada em 2 estudos randomizados, estudos clínicos duplo-cegos e controlados por placebo (Estudos 1 e 2) realizados nos Estados Unidos que avaliaram a função cognitiva e a função do dia-a-dia. A idade média dos pacientes participantes desses dois estudos foi de 76, com um intervalo de 50 a 93 anos. Aproximadamente 66% dos pacientes eram do sexo feminino e 91% dos pacientes eram caucasianos.
Um terceiro estudo (Estudo 3), realizado na Letônia, registrou pacientes com demência grave, mas não avaliou a função cognitiva como um desfecho planejado.
Medidas de resultado do estudo: em cada estudo dos EUA, a eficácia do Namenda foi determinada usando um instrumento projetado para avaliar a função geral por meio da avaliação relacionada ao cuidador e um instrumento que mede conhecimento. Ambos os estudos mostraram que os pacientes em Namenda experimentaram uma melhora significativa em ambas as medidas em comparação ao placebo.
A função do dia-a-dia foi avaliada em ambos os estudos, usando o inventário Estudo Cooperativo - Atividades da Vida Diária (ADCS-ADL). O ADCS-ADL consiste em uma bateria abrangente de perguntas sobre ADL usadas para medir as capacidades funcionais dos pacientes. Cada item de ADL é classificado no nível mais alto de desempenho independente para concluir a perda. O investigador realiza o inventário entrevistando um cuidador familiarizado com o comportamento do paciente. Um subconjunto de 19 itens, incluindo classificações da capacidade do paciente de comer, vestir, tomar banho, telefone, viajar, fazer compras, e realizar outras tarefas domésticas foi validado para a avaliação de pacientes com moderada a grave demência. Este é o ADCS-ADL modificado, que possui uma faixa de pontuação de 0 a 54, com as pontuações mais baixas indicando maior comprometimento funcional.
A capacidade do Namenda de melhorar o desempenho cognitivo foi avaliada em ambos os estudos com a Bateria de Comprometimento Grave (SIB), uma instrumento multiteste validado para avaliação da função cognitiva em pacientes com moderada a grave demência. O SIB examina aspectos selecionados do desempenho cognitivo, incluindo elementos de atenção, orientação, linguagem, memória, capacidade visuoespacial, construção, práxis e interação social. A faixa de pontuação do SIB é de 0 a 100, com pontuações mais baixas indicando maior comprometimento cognitivo.
Estudo 1 (estudo de vinte e oito semanas)
Em um estudo de 28 semanas de duração, 252 pacientes com doença de Alzheimer provável moderada a grave (diagnosticada pelo DSM-IV e NINCDS-ADRDA critérios, com pontuações no Mini-Mental State Examination> / = 3 e! - = 14 e Etapas da Escala Global de Deterioração 5-6) foram randomizados para Namenda ou placebo. Para os pacientes randomizados para Namenda, o tratamento foi iniciado com 5 mg uma vez ao dia e aumentado semanalmente em 5 mg / dia em doses divididas para uma dose de 20 mg / dia (10 mg duas vezes ao dia).
Efeitos no ADCS-ADL:
A Figura 1 mostra o curso de tempo para a mudança da linha de base na pontuação ADCS-ADL para pacientes nos dois grupos de tratamento que completaram as 28 semanas do estudo. Com 28 semanas de tratamento, a diferença média nos escores de alteração ADCS-ADL para os pacientes tratados com Namenda em comparação com os pacientes que receberam placebo foi de 3,4 unidades. Usando uma análise baseada em todos os pacientes e levando adiante sua última observação do estudo (análise LOCF), o tratamento com Namenda foi estatisticamente significativamente superior ao placebo.
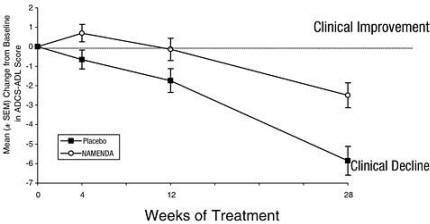
Figura 1: Evolução temporal da mudança da linha de base no escore ADCS-ADL para pacientes que completaram 28 semanas de tratamento.
A Figura 2 mostra as porcentagens cumulativas de pacientes de cada um dos grupos de tratamento que atingiram pelo menos a alteração no ADCS-ADL mostrada no eixo X.
As curvas mostram que os pacientes designados para Namenda e placebo têm uma ampla gama de respostas e geralmente mostram deterioração (uma mudança negativa na ADCS-ADL em comparação à linha de base), mas que o grupo Namenda tem mais probabilidade de mostrar um declínio menor ou um melhoria. (Em uma exibição de distribuição cumulativa, uma curva para um tratamento efetivo seria deslocada para a esquerda da curva para placebo, enquanto um tratamento ineficaz ou deletério seria sobreposto ou deslocado para a direita da curva para placebo.)
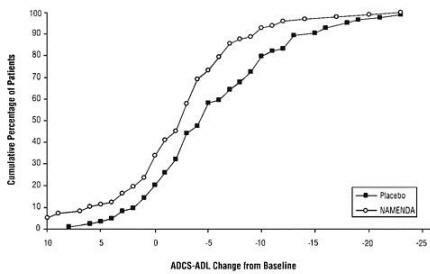
Figura 2: Porcentagem cumulativa de pacientes que completaram 28 semanas de tratamento duplo-cego com alterações especificadas desde o início nos escores ADCS-ADL.
Efeitos no SIB: A Figura 3 mostra o tempo decorrido para a mudança da linha de base na pontuação do SIB para os dois grupos de tratamento nas 28 semanas de estudo. Com 28 semanas de tratamento, a diferença média nos escores de alteração do SIB para os pacientes tratados com Namenda em comparação com os pacientes que receberam placebo foi de 5,7 unidades. Usando uma análise LOCF, o tratamento com Namenda foi estatisticamente significativamente superior ao placebo.
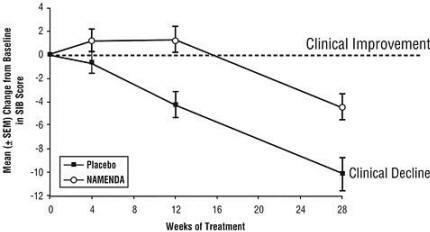
Figura 3: Evolução temporal da mudança da linha de base na pontuação do SIB para pacientes que completaram 28 semanas de tratamento.
A Figura 4 mostra as porcentagens cumulativas de pacientes de cada grupo de tratamento que atingiram pelo menos a medida da alteração na pontuação do SIB mostrada no eixo X.
As curvas mostram que os pacientes designados para Namenda e placebo têm uma ampla gama de respostas e geralmente mostram deterioração, mas é mais provável que o grupo Namenda mostre um declínio menor ou um melhoria.
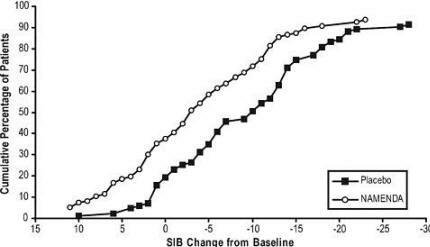
Figura 4: Porcentagem cumulativa de pacientes que completaram 28 semanas de tratamento duplo-cego com alterações especificadas desde a linha de base nas pontuações do SIB.
Estudo 2 (Estudo de vinte e quatro semanas) Em um estudo de 24 semanas, 404 pacientes com moderada a grave provável doença de Alzheimer (diagnosticada pelos critérios NINCDS-ADRDA, com Mini Exame do Estado Mental pontuações ≥ 5 e ≤ 14) que foram tratados com donepezil por pelo menos 6 meses e que estavam em uma dose estável de O donepezil nos últimos 3 meses foi randomizado para Namenda ou placebo enquanto ainda recebia donepezil. Para os pacientes randomizados para Namenda, o tratamento foi iniciado com 5 mg uma vez ao dia e aumentado semanalmente em 5 mg / dia em doses divididas para uma dose de 20 mg / dia (10 mg duas vezes ao dia).
Efeitos no ADCS-ADL: A Figura 5 mostra o tempo decorrido para a mudança da linha de base na pontuação ADCS-ADL para os dois grupos de tratamento nas 24 semanas do estudo. Às 24 semanas de tratamento, a diferença média nos escores de alteração ADCS-ADL para o Namenda / donepezil doentes tratados (terapêutica combinada) em comparação com os doentes tratados com placebo / donepezil (monoterapia) foi de 1,6 unidades. Usando uma análise LOCF, o tratamento com Namenda / donepezil foi estatisticamente significativamente superior ao placebo / donepezil.
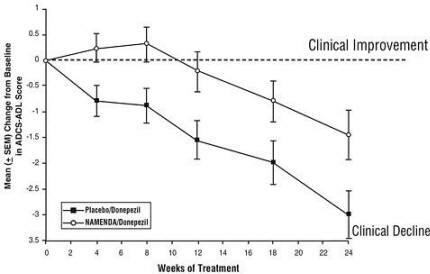
Figura 5: Evolução temporal da mudança da linha de base no escore ADCS-ADL para pacientes que completaram 24 semanas de tratamento.
A Figura 6 mostra as porcentagens cumulativas de pacientes de cada um dos grupos de tratamento que atingiram pelo menos a medida de melhora no ADCS-ADL mostrada no eixo X.
As curvas mostram que os pacientes designados para Namenda / donepezil e placebo / donepezil têm uma ampla gama de respostas e geralmente mostram deterioração, mas é mais provável que o grupo Namenda / donepezil mostre um declínio menor ou um melhoria.
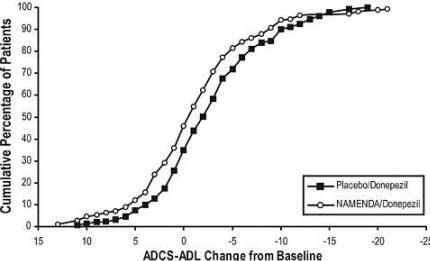
Figura 6: Porcentagem cumulativa de pacientes que completaram 24 semanas de tratamento duplo-cego com alterações especificadas desde o início nos escores ADCS-ADL.
Efeitos no SIB: A Figura 7 mostra o tempo decorrido para a alteração da linha de base na pontuação do SIB para os dois grupos de tratamento nas 24 semanas do estudo. Às 24 semanas de tratamento, a diferença média nas pontuações de alteração do SIB para os pacientes tratados com Namenda / donepezil em comparação com os pacientes que receberam placebo / donepezil foi de 3,3 unidades. Usando uma análise LOCF, o tratamento com Namenda / donepezil foi estatisticamente significativamente superior ao placebo / donepezil.
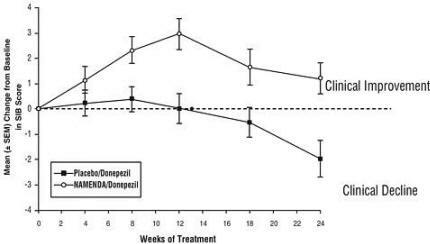
Figura 7: Evolução temporal da mudança da linha de base na pontuação do SIB para pacientes que completaram 24 semanas de tratamento.
A Figura 8 mostra as porcentagens cumulativas de pacientes de cada grupo de tratamento que atingiram pelo menos a medida de melhora na pontuação SIB mostrada no eixo X.
As curvas mostram que os pacientes designados para Namenda / donepezil e placebo / donepezil têm uma ampla gama respostas, mas é mais provável que o grupo Namenda / donepezil mostre uma melhoria ou uma menor declínio.
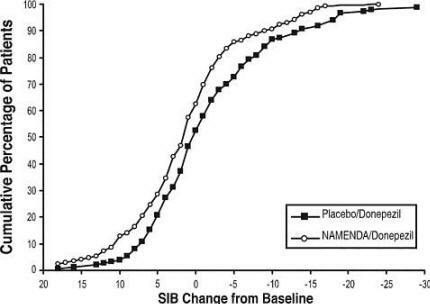
Figura 8: Porcentagem acumulada de pacientes que completaram 24 semanas de tratamento duplo-cego com alterações especificadas em relação à linha de base nas pontuações do SIB.
Estudo 3 (estudo de doze semanas) Em um estudo duplo-cego de 12 semanas de duração, realizado em casas de repouso na Letônia, 166 pacientes com demência de acordo com para o DSM-III-R, uma pontuação no Mini-Mental State Examination de <10 e a escala Global Deterioration Scale de 5 a 7 foram randomizados para Namenda ou placebo. Para os pacientes randomizados para Namenda, o tratamento foi iniciado com 5 mg uma vez ao dia e aumentado para 10 mg uma vez ao dia após 1 semana. As principais medidas de eficácia foram a subescala de dependência de cuidados da Escala de Avaliação Comportamental para Pacientes Geriátricos (BGP), uma medida da função cotidiana e uma Impressão Clínica Clínica da Mudança (CGI-C), uma medida da clínica geral efeito. Nenhuma medida válida da função cognitiva foi usada neste estudo. Uma diferença de tratamento estatisticamente significativa em 12 semanas que favoreceu Namenda em relação ao placebo foi observada nas duas medidas primárias de eficácia. Como os pacientes entrados eram uma mistura da doença de Alzheimer e demência vascular, foi feita uma tentativa de distinguir os dois grupos e todos os pacientes foram posteriormente designados como tendo demência vascular ou doença de Alzheimer, com base em suas pontuações na Escala Isquêmica de Hachinski no estudo entrada. Apenas cerca de 50% dos pacientes realizaram tomografia computadorizada do cérebro. Para o subconjunto designado como portador da doença de Alzheimer, foi observado um efeito de tratamento estatisticamente significativo, favorecendo Namenda em relação ao placebo, em 12 semanas, tanto no BGP quanto no CGI-C.
Indicações e uso
Namenda (cloridrato de memantina) é indicado para o tratamento de demência moderada a grave do tipo Alzheimer.
Contra-indicações
Namenda (cloridrato de memantina) é contra-indicado em pacientes com hipersensibilidade conhecida ao cloridrato de memantina ou a qualquer excipiente usado na formulação.
Precauções
Informações para pacientes e cuidadores: Os cuidadores devem ser instruídos na administração recomendada (duas vezes por dia para doses acima de 5 mg) e escalonamento da dose (intervalo mínimo de uma semana entre os aumentos de dose).
Crises de condições neurológicas:
Namenda não foi avaliado sistematicamente em pacientes com um distúrbio convulsivo. Nos ensaios clínicos de Namenda, ocorreram convulsões em 0,2% dos pacientes tratados com Namenda e em 0,5% dos pacientes tratados com placebo.
Condições geniturinárias
Condições que aumentam o pH da urina podem diminuir a eliminação urinária da memantina, resultando em níveis plasmáticos aumentados de memantina.
Populações Especiais
Compromisso hepático
Namenda sofre metabolismo hepático parcial, com cerca de 48% da dose administrada excretada na urina como medicamento inalterado ou como a soma do medicamento original e do conjugado N-glucuronídeo (74%). A farmacocinética da memantina em pacientes com insuficiência hepática não foi investigada, mas seria esperado que fosse apenas modestamente afetado.
Insuficiência renal
Não é necessário ajuste posológico em pacientes com insuficiência renal leve ou moderada. Recomenda-se uma redução da dose em pacientes com insuficiência renal grave (ver FARMACOLOGIA CLÍNICA e DOSAGEM E ADMINISTRAÇÃO ).
Interações medicamentosas
N-metil-D-aspartato (NMDA) Antagonistas: O uso combinado de Namenda com outros antagonistas do NMDA (amantadina, cetamina e dextrometorfano) não foi avaliado sistematicamente e esse uso deve ser abordado com cautela.
Efeitos de Namenda em substratos de enzimas microssomais: Estudos in vitro realizados com substratos marcadores das enzimas CYP450 (CYP1A2, -2A6, -2C9, -2D6, -2E1, -3A4) mostraram uma inibição mínima dessas enzimas pela memantina. Além disso, estudos in vitro indicam que, em concentrações superiores às associadas à eficácia, a memantina não induz as isozimas do citocromo P450 CYP1A2, CYP2C9, CYP2E1 e CYP3A4 / 5. Não são esperadas interações farmacocinéticas com medicamentos metabolizados por essas enzimas.
Efeitos de inibidores e / ou substratos de enzimas microssomais em Namenda: A memantina é predominantemente eliminada por via renal, e não se espera que medicamentos que sejam substratos e / ou inibidores do sistema CYP450 alterem o metabolismo da memantina.
Inibidores da acetilcolinesterase (AChE): A administração concomitante de Namenda com o inibidor da AChE donepezil HCl não afetou a farmacocinética de nenhum dos compostos. Num estudo clínico controlado de 24 semanas em doentes com doença de Alzheimer moderada a grave, os efeitos adversos O perfil do evento observado com uma combinação de memantina e donepezil foi semelhante ao do donepezil isolado.
Medicamentos eliminados por mecanismos renais: Como a memantina é eliminada em parte pela secreção tubular, a co-administração de medicamentos que usam o mesmo sistema catiônico renal, incluindo hidroclorotiazida (HCTZ), triamtereno (TA), metformina, cimetidina, ranitidina, quinidina e nicotina, podem resultar em níveis plasmáticos alterados de ambos os agentes. No entanto, a co-administração de Namenda e HCTZ / AT não afetou a biodisponibilidade de memantina ou AT, e a biodisponibilidade de HCTZ diminuiu 20%. Além disso, a co-administração de memantina com o medicamento anti-hiperglicêmico Glucovance® (gliburida e metformina HCl) não afetou a farmacocinética da memantina, metformina e gliburida. Além disso, a memantina não modificou o efeito sérico de redução da glicose do Glucovance®.
Medicamentos que tornam a urina alcalina: A depuração da memantina foi reduzida em cerca de 80% em condições de urina alcalina a pH 8. Portanto, alterações do pH da urina em relação à condição alcalina podem levar ao acúmulo do fármaco com possível aumento de efeitos adversos. O pH da urina é alterado pela dieta, medicamentos (por exemplo, inibidores da anidrase carbônica, bicarbonato de sódio) e estado clínico do paciente (por exemplo, acidose tubular renal ou infecções graves do trato urinário). Portanto, a memantina deve ser usada com cautela nessas condições.
Carcinogênese, mutagênese e comprometimento da fertilidade
Não houve evidência de carcinogenicidade em um estudo oral de 113 semanas em camundongos com doses de até 40 mg / kg / dia (10 vezes a dose máxima humana recomendada [MRHD] em mg / m 2). Também não houve evidência de carcinogenicidade em ratos administrados por via oral em até 40 mg / kg / dia por 71 semanas seguido por 20 mg / kg / dia (20 e 10 vezes o MRHD em mg / m 2, respectivamente) por 128 semanas.
A memantina não produziu evidência de potencial genotóxico quando avaliada no S. in vitro. typhimurium ou E. ensaio de mutação reversa coli, teste de aberração cromossômica in vitro em linfócitos humanos, teste citogenético in vivo para danos cromossômicos em ratos e ensaio de micronúcleo de camundongo in vivo. Os resultados foram ambíguos em um ensaio de mutação genética in vitro utilizando células V79 de hamster chinês.
Não foi observado comprometimento da fertilidade ou desempenho reprodutivo em ratos administrados até 18 mg / kg / dia (9 vezes o MRHD em um mg / m 2) por via oral a partir de 14 dias antes do acasalamento durante a gestação e lactação em fêmeas ou por 60 dias antes do acasalamento em machos.
Gravidez
Gravidez Categoria B: A memantina administrada por via oral a ratos e coelhos prenhes durante o período de organogênese não foi teratogênica até as doses mais altas testadas (18 mg / kg / dia em ratos e 30 mg / kg / dia em coelhos, que são 9 e 30 vezes, respectivamente, a dose máxima humana recomendada [MRHD] em mg / m 2 base).
Toxicidade materna leve, diminuição do peso dos filhotes e aumento da incidência de vértebras cervicais não ossificadas foram observados dose de 18 mg / kg / dia em um estudo em que os ratos receberam memantina por via oral começando o pré-acasalamento e continuando durante o pós-parto período. Também foi observada uma leve toxicidade materna e diminuição do peso dos filhotes nessa dose em um estudo em que ratos foram tratados desde o dia 15 de gestação até o período pós-parto. A dose sem efeito para esses efeitos foi de 6 mg / kg, que é 3 vezes a MRHD em mg / m 2.
Não existem estudos adequados e bem controlados sobre memantina em mulheres grávidas. A memantina deve ser usada durante a gravidez apenas se o benefício potencial justificar o risco potencial para o feto.
Mães que amamentam
Não se sabe se a memantina é excretada no leite materno. Como muitos medicamentos são excretados no leite humano, deve-se ter cuidado quando a memantina é administrada a uma mãe que amamenta.
Uso pediátrico
Não há estudos adequados e bem controlados que documentem a segurança e eficácia da memantina em qualquer doença que ocorra em crianças.
Reações adversas
A experiência descrita nesta seção deriva de estudos em pacientes com doença de Alzheimer e demência vascular.
Eventos adversos que levam à descontinuação: Em estudos controlados por placebo, nos quais pacientes com demência receberam doses de Namenda até 20 mg / dia, o A probabilidade de descontinuação devido a um evento adverso foi a mesma no grupo Namenda e no grupo placebo grupo. Nenhum evento adverso individual foi associado à descontinuação do tratamento em 1% ou mais dos pacientes tratados com Namenda e a uma taxa maior que o placebo.
Eventos adversos relatados em ensaios controlados: Os eventos adversos relatados nos ensaios de Namenda (cloridrato de memantina) refletem a experiência adquirida sob condições monitoradas de perto em uma população de pacientes altamente selecionada. Na prática real ou em outros ensaios clínicos, essas estimativas de frequência podem não se aplicar, pois as condições de uso, o comportamento do relatório e os tipos de pacientes tratados podem diferir. A Tabela 1 lista os sinais e sintomas emergentes do tratamento que foram relatados em pelo menos 2% dos pacientes em pacientes controlados por placebo demência e para os quais a taxa de ocorrência foi maior nos pacientes tratados com Namenda do que naqueles tratados com placebo. Nenhum evento adverso ocorreu com uma frequência de pelo menos 5% e duas vezes a taxa de placebo.
Sistema do corpo |
Placebo (N = 922) % |
Namenda (N = 940) % |
Corpo como um todo | ||
Fadiga |
1 | 2 |
Dor |
1 | 3 |
Sistema cardiovascular | ||
Hipertensão |
2 | 4 |
Sistema Nervoso Central e Periférico | ||
Tontura |
5 | 7 |
Dor de cabeça |
3 | 6 |
Sistema gastrointestinal | ||
Prisão de ventre |
3 | 5 |
Vômito |
2 | 3 |
Sistema musculo-esquelético | ||
Dor nas costas |
2 | 3 |
Distúrbios psiquiátricos | ||
Confusão |
5 | 6 |
Sonolência |
2 | 3 |
Alucinação |
2 | 3 |
Sistema respiratório | ||
Tosse |
3 | 4 |
Dispnéia |
1 | 2 |
Outros eventos adversos que ocorreram com uma incidência de pelo menos 2% nos pacientes tratados com Namenda, mas com uma taxa maior ou igual ao placebo foram agitação, queda, lesão infligida, incontinência urinária, diarréia, bronquite, insônia, infecção do trato urinário, sintomas semelhantes à influenza, marcha anormal, depressão, infecção do trato respiratório superior, ansiedade, edema periférico, náusea, anorexia e artralgia.
O perfil geral de eventos adversos e as taxas de incidência de eventos adversos individuais na subpopulação de pacientes com doença de Alzheimer moderada a grave não foram diferentes do perfil e das taxas de incidência descritas acima para a demência geral população.
Alterações nos sinais vitais: Os grupos Namenda e placebo foram comparados com relação à (1) alteração média da linha de base nos sinais vitais (pulso, pressão arterial sistólica, sangue diastólico) pressão e peso) e (2) a incidência de pacientes que atendem aos critérios de alterações potencialmente clinicamente significativas variáveis. Não houve alterações clinicamente importantes nos sinais vitais em pacientes tratados com Namenda. Uma comparação das medidas dos sinais vitais em decúbito dorsal e permanente para Namenda e placebo em indivíduos normais idosos indicou que o tratamento com Namenda não está associado a alterações ortostáticas.
Alterações laboratoriais: Os grupos Namenda e placebo foram comparados com relação à (1) alteração média da linha de base em várias químicas, hematologia e análises de urina e (2) a incidência de pacientes que atendem aos critérios para alterações potencialmente clinicamente significativas desde o início variáveis. Essas análises não revelaram alterações clinicamente importantes nos parâmetros dos testes laboratoriais associados ao tratamento com Namenda.
Alterações no ECG: Os grupos Namenda e placebo foram comparados com relação a (1) alteração média da linha de base em vários parâmetros de ECG e (2) incidência de pacientes que atendem aos critérios de alterações potencialmente clinicamente significativas variáveis. Essas análises não revelaram alterações clinicamente importantes nos parâmetros de ECG associados ao tratamento com Namenda.
Outros eventos adversos observados durante ensaios clínicos
Namenda foi administrado a aproximadamente 1350 pacientes com demência, dos quais mais de 1200 receberam a dose máxima recomendada de 20 mg / dia. Os pacientes receberam tratamento Namenda por períodos de até 884 dias, com 862 pacientes recebendo pelo menos 24 semanas de tratamento e 387 pacientes recebendo 48 semanas ou mais de tratamento.
Sinais e sintomas emergentes do tratamento que ocorreram durante 8 ensaios clínicos controlados e 4 ensaios abertos os ensaios clínicos foram registrados como eventos adversos pelos investigadores clínicos, usando terminologia própria escolhendo. Para fornecer uma estimativa geral da proporção de indivíduos com tipos semelhantes de eventos, os eventos foram agrupados num número menor de categorias padronizadas usando a terminologia da OMS, e as frequências de eventos foram calculadas em todos os estudos.
Todos os eventos adversos que ocorrem em pelo menos dois pacientes estão incluídos, exceto aqueles já listados na Tabela 1, termos da OMS também geral, informativo, sintomas ou eventos menores improváveis de serem causados por drogas, por exemplo, porque são comuns no estudo população. Os eventos são classificados por sistema corporal e listados usando as seguintes definições: eventos adversos freqüentes - aqueles que ocorrem em pelo menos 1/100 pacientes; eventos adversos pouco frequentes - aqueles que ocorrem em 1/100 a 1/1000 pacientes. Esses eventos adversos não estão necessariamente relacionados ao tratamento com Namenda e, na maioria dos casos, foram observados com uma frequência semelhante em pacientes tratados com placebo nos estudos controlados.
Corpo como um todo: Frequente: síncope. Infreqüente: hipotermia, reação alérgica.
Sistema cardiovascular: Frequente: insuficiência cardíaca. Pouco frequentes: angina de peito, bradicardia, infarto do miocárdio, tromboflebite, fibrilação atrial, hipotensão, parada cardíaca, hipotensão postural, embolia pulmonar, edema pulmonar.
Sistema Nervoso Central e Periférico: Frequente: ataque isquêmico transitório, acidente vascular cerebral, vertigem, ataxia, hipocinesia. Pouco frequentes: parestesia, convulsões, distúrbio extrapiramidal, hipertonia, tremor, afasia, hipoestesia, anormal coordenação, hemiplegia, hipercinesia, contrações musculares involuntárias, estupor, hemorragia cerebral, neuralgia, ptose, neuropatia.
Sistema gastrointestinal: Pouco frequente: gastroenterite, diverticulite, hemorragia gastrointestinal, melena, ulceração esofágica.
Distúrbios hemáticos e linfáticos: Frequente: anemia. Pouco frequente: leucopenia.
Distúrbios metabólicos e nutricionais: Frequente: aumento da fosfatase alcalina e aumento do peso. Infreqüentes: desidratação, hiponatremia, diabetes mellitus agravado.
Distúrbios psiquiátricos: Frequente: reação agressiva. Pouco frequentes: ilusão, distúrbio de personalidade, instabilidade emocional, nervosismo, distúrbio do sono, aumento da libido, psicose, amnésia, apatia, reação paranóica, pensamento anormal, choro anormal, apetite aumentado, paroniria, delírio, despersonalização, neurose, suicídio tentativa.
Sistema respiratório: Frequente: pneumonia. Infreqüente: apneia, asma, hemoptise.
Pele e anexos: Frequente: erupção cutânea. Pouco frequentes: ulceração da pele, prurido, celulite, eczema, dermatite, erupção cutânea eritematosa, alopecia, urticária.
Sentidos Especiais: Frequente: catarata, conjuntivite. Pouco frequentes: degeneração da mácula lutea, diminuição da acuidade visual, diminuição da audição, zumbido, blefarite, visão turva, opacidade da córnea, glaucoma, hemorragia conjuntival, dor ocular, hemorragia retiniana, xeroftalmia, diplopia, lacrimação anormal, miopia, descolamento de retina.
Sistema urinário: Frequente: micção frequente. Infreqüente: disúria, hematúria, retenção urinária.
Eventos Relatados Posteriormente ao Marketing de Namenda, EUA e Ex-EUA
Embora não tenha sido encontrada nenhuma relação causal com o tratamento com memantina, os seguintes eventos adversos foram relatados como associados temporariamente ao tratamento com memantina e não são descrito em outras partes da rotulagem: bloqueio atrioventricular, fratura óssea, síndrome do túnel do carpo, infarto cerebral, dor no peito, claudicação, colite, discinesia, disfagia, gastrite, refluxo gastroesofágico, convulsões do grande mal, hemorragia intracraniana, insuficiência hepática, hiperlipidemia, hipoglicemia, íleo, impotência, mal-estar, síndrome maligna dos neurolépticos, aguda pancreatite, pneumonia por aspiração, insuficiência renal aguda, intervalo QT prolongado, inquietação, síndrome de Stevens-Johnson, morte súbita, taquicardia supraventricular, taquicardia tardia discinesia e trombocitopenia.
TOXICOLOGIA ANIMAL
Lesões neuronais induzidas por memantina (vacuolação e necrose) nas células multipolares e piramidais nas camadas corticais III e IV da região posterior neocortices cingulados e retrospleniais em ratos, semelhantes aos que se sabe ocorrerem em roedores administrados outros antagonistas dos receptores NMDA. As lesões foram observadas após uma dose única de memantina. Num estudo em que os ratos receberam doses orais diárias de memantina durante 14 dias, a dose sem efeito para necrose neuronal foi 6 vezes a dose humana máxima recomendada em mg / m 2. O potencial de indução da vacuolização neuronal central e necrose por antagonistas do receptor NMDA em humanos é desconhecido.
ABUSO E DEPENDÊNCIA DE DROGAS
Classe de Substância Controlada: Memantina HCl não é uma substância controlada.
Dependência Física e Psicológica: Memantina HCl é um antagonista não competitivo de NMDA de afinidade baixa a moderada que não produziu nenhuma evidência de busca de drogas sintomas de comportamento ou abstinência após descontinuação em 2.504 pacientes que participaram de ensaios clínicos em doses. Os dados pós-marketing, fora dos EUA, coletados retrospectivamente, não forneceram evidências de abuso ou dependência de drogas.
Overdose
Como as estratégias para o gerenciamento de overdose estão em constante evolução, é aconselhável entrar em contato com um controle de envenenamento para determinar as recomendações mais recentes para o tratamento de uma overdose de qualquer droga.
Como em todos os casos de sobredosagem, devem ser utilizadas medidas gerais de suporte e o tratamento deve ser sintomático. A eliminação da memantina pode ser aumentada pela acidificação da urina. Em um caso documentado de sobredosagem com até 400 mg de memantina, o paciente experimentou inquietação, psicose, alucinações visuais, sonolência, estupor e perda de consciência. O paciente se recuperou sem sequelas permanentes.
Dosagem e Administração
A dosagem de Namenda (cloridrato de memantina) demonstrou ser eficaz em ensaios clínicos controlados é de 20 mg / dia.
A dose inicial recomendada de Namenda é de 5 mg uma vez ao dia. A dose alvo recomendada é 20 mg / dia. A dose deve ser aumentada em incrementos de 5 mg a 10 mg / dia (5 mg duas vezes por dia), 15 mg / dia (5 mg e 10 mg em doses separadas) e 20 mg / dia (10 mg duas vezes por dia). O intervalo mínimo recomendado entre aumentos da dose é de uma semana.
Namenda pode ser tomado com ou sem alimentos.
Os pacientes / profissionais de saúde devem ser instruídos sobre como usar o dispositivo de dosagem Namenda Oral Solution. Eles devem estar cientes da folha de instruções do paciente que acompanha o produto. Os pacientes / profissionais de saúde devem ser instruídos a abordar qualquer dúvida sobre o uso da solução ao seu médico ou farmacêutico.
Doses em populações especiais
Recomenda-se uma dose alvo de 5 mg duas vezes ao dia em pacientes com insuficiência renal grave (depuração da creatinina de 5 - 29 mL / min com base na equação de Cockroft-Gault):
Para homens: CLcr = [140 anos (anos)] · Peso (kg) / [72 · creatinina sérica (mg / dL)]
Para mulheres: CLcr = 0,85 · [140 anos (anos)] · Peso (kg) / [72 · creatinina sérica (mg / dL)]
Como fornecido
Comprimido de 5 mg:
Garrafa de 60 NDC # 0456-3205-60
Dose unitária 10 × 10 NDC # 0456-3205-63
Os comprimidos revestidos por película em forma de cápsula são marrons, com a força (5) gravada em um lado e FL no outro.
10 mg comprimido:
Garrafa de 60 NDC # 0456-3210-60
10 x 10 Dose unitária NDC # 0456-3210-63
Os comprimidos revestidos por película em forma de cápsula são cinza, com a força (10) gravada em um lado e FL no outro.
Titulação Pak:
Embalagem blister de PVC / alumínio contendo 49 comprimidos. 28 x 5 mg e 21 x 10 mg comprimidos. NDC # 0456-3200-14
Os comprimidos revestidos por película, em forma de cápsula de 5 mg, são castanhos, com a força (5) gravada em um lado e FL no outro. Os comprimidos revestidos por película em forma de cápsula de 10 mg são cinza, com a força (10) gravada em um lado e FL no outro.
Solução oral:
As recomendações de dosagem para solução oral são as mesmas que para os comprimidos. A solução oral é clara, sem álcool, sem açúcar e com sabor a menta.
2 mg / mL Solução Oral (10 mg = 5 mL)
12 fl. oz. Frasco (360 mL) NDC # 0456-3202-12
Armazenar a 25 ° C (77 ° F); excursões permitidas a 15-30 ° C (59-86 ° F) [consulte Temperatura ambiente controlada pela USP].
Forest Pharmaceuticals, Inc. Empresas
Subsidiária de Forest Laboratories, Inc.
St. Louis, MO 63045
Licenciado pela Merz Pharmaceuticals GmbH
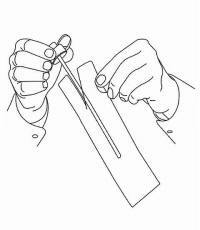
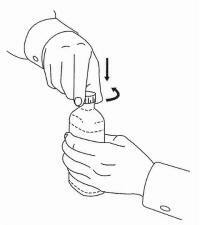
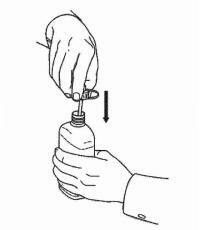
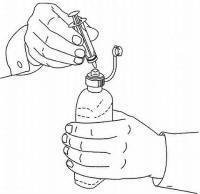
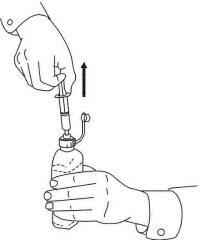
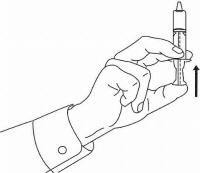
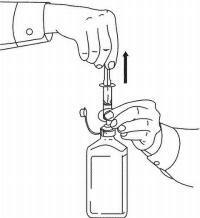
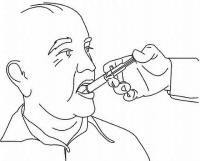
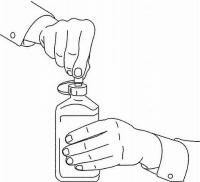
INSTRUÇÕES DO PACIENTE PARA A Solução Oral NAMENDA®
Siga as instruções abaixo para usar o seu dispositivo de dosagem Namenda® Oral Solution.
IMPORTANTE: Leia estas instruções antes de usar o Namenda® Oral Solution.
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
IMPORTANTE: As informações desta monografia não se destinam a cobrir todos os usos possíveis, instruções, precauções, interações medicamentosas ou efeitos adversos. Esta informação é generalizada e não se destina a aconselhamento médico específico. Se você tiver dúvidas sobre os medicamentos que está tomando ou quiser obter mais informações, consulte seu médico, farmacêutico ou enfermeiro. Última atualização em 4/07.
Fonte: Forest Laboratories, distribuidor dos EUA da Namenda.
Informações do paciente da Namenda (em inglês)
de volta a: Página inicial de farmacologia de medicamentos psiquiátricos

