Informações completas de prescrição de iloperidona (fanapt)
Marca: Fanapt
Nome genérico: Iloperidona
Guia de Prescrição de Fanapt (Iloperidone) (PDF)
Conteúdo:
Aviso em caixa
Indicações e uso
Dosagem e Administração
Contra-indicações
Avisos e Precauções
Reações adversas
Interações medicamentosas
Uso em populações específicas
Abuso e dependência de drogas
Overdose
Descrição
Farmacologia Clínica
Toxicologia Não Clínica
Estudos clínicos
Como fornecido
Guia de Medicamentos Brintellix
AVISO: MORTALIDADE AUMENTADA EM PACIENTES IDOSOS COM PSICOSE RELACIONADA À DEMÊNCIA
Pacientes idosos com psicose relacionada à demência tratados com antipsicóticos correm um risco aumentado de morte. O FANAPT não está aprovado para o tratamento de pacientes com psicose relacionada à demência.
Indicações e uso
FANAPT® está indicado no tratamento da esquizofrenia em adultos.
Ao decidir entre os tratamentos alternativos disponíveis para essa condição, o prescritor deve considerar o achado de que o FANAPT está associado ao prolongamento do intervalo QTc. O prolongamento do intervalo QTc está associado a alguns outros fármacos com a capacidade de causar torsade de arritmia do tipo pointes, uma taquicardia ventricular polimórfica potencialmente fatal que pode resultar em morte. Em muitos casos, isso levaria à conclusão de que outros medicamentos deveriam ser experimentados primeiro. Ainda não se sabe se o FANAPT irá causar torsade de pointes ou aumentar a taxa de morte súbita.
Os pacientes devem ser titulados para uma dose eficaz de FANAPT. Assim, o controle dos sintomas pode ser retardado durante as primeiras 1 a 2 semanas de tratamento em comparação com outros medicamentos antipsicóticos que não requerem uma titulação semelhante. Os prescritores devem estar atentos a esse atraso ao selecionar um medicamento antipsicótico para o tratamento da esquizofrenia.
continuar a história abaixo
Dosagem e Administração
Dose habitual
O FANAPT deve ser titulado lentamente a partir de uma dose inicial baixa para evitar hipotensão ortostática devido às suas propriedades de bloqueio alfa-adrenérgico. A dose inicial recomendada para os comprimidos de FANAPT é de 1 mg por via oral duas vezes ao dia. Os aumentos de dose para atingir a faixa alvo de 6 a 12 mg duas vezes ao dia (12_24 mg / dia) podem ser feitos com ajustes posológicos diários para não exceder 2 mg duas vezes ao dia (4 mg / dia). A dose máxima recomendada é de 12 mg duas vezes ao dia (24 mg / dia). Doses de FANAPT acima de 24 mg / dia não foram avaliadas sistematicamente nos ensaios clínicos. A eficácia foi demonstrada com FANAPT em um intervalo de doses de 6 a 12 mg duas vezes ao dia. Os prescritores devem estar atentos ao fato de que os pacientes precisam ser titulados para uma dose eficaz de FANAPT. Assim, o controle dos sintomas pode ser retardado durante as primeiras 1 a 2 semanas de tratamento em comparação com outros medicamentos antipsicóticos que não requerem titulação semelhante. Os prescritores também devem estar cientes de que alguns efeitos adversos associados ao uso de FANAPT estão relacionados à dose. O FANAPT pode ser administrado sem levar em consideração as refeições.
Dosagem em populações especiais
Ajuste posológico em doentes a tomar FANAPT concomitantemente com potenciais inibidores da CYP2D6: a dose de FANAPT deve ser reduzido pela metade quando administrado concomitantemente com fortes inibidores da CYP2D6, como fluoxetina ou paroxetina. Quando o inibidor da CYP2D6 é retirado da terapia combinada, a dose de FANAPT deve ser aumentada para onde estava antes.
Ajuste posológico em doentes a tomar FANAPT concomitantemente com potenciais inibidores da CYP3A4: a dose de FANAPT deve ser reduzido pela metade quando administrado concomitantemente com inibidores fortes do CYP3A4, como cetoconazol ou claritromicina. Quando o inibidor do CYP3A4 é retirado da terapia combinada, a dose de FANAPT deve ser aumentada para onde estava antes.
Ajuste da dose para pacientes que tomam FANAPT que são metabolizadores fracos do CYP2D6: a dose de FANAPT deve ser reduzida pela metade para metabolizadores fracos do CYP2D6.
Insuficiência hepática: Não é necessário ajuste da dose de FANAPT em pacientes com insuficiência hepática leve. Pacientes com insuficiência hepática moderada podem precisar de redução da dose, se clinicamente indicado. FANAPT não é recomendado em doentes com compromisso hepático grave.
Tratamento de Manutenção
Em um estudo de longo prazo, o FANAPT foi eficaz em retardar o tempo de recidiva em pacientes com esquizofrenia que foram estabilizados no FANAPT até 24 mg / dia. Os pacientes devem ser reavaliados periodicamente para determinar a necessidade de tratamento de manutenção.
Reinicialização do tratamento em pacientes descontinuados anteriormente Embora não haja dados para abordar especificamente a reinicialização de recomenda-se que o esquema de titulação de iniciação seja seguido sempre que os pacientes tiverem um intervalo de mais de de 3 dias.
topo
Formas e dosagens de dosagem
Os comprimidos de FANAPT estão disponíveis nas seguintes dosagens: 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg e 12 mg. Os comprimidos são brancos, redondos, planos, com bordas chanfradas e identificados com o logotipo “” gravado em um lado e força “1”, “2”, “4”, “6”, “8”, “10”, ou "12" gravado no outro lado.
topo
Contra-indicações
FANAPT está contra-indicado em indivíduos com uma reação de hipersensibilidade conhecida ao produto. Anafilaxia, angioedema e outras reações de hipersensibilidade foram relatadas.
topo
AVISOS E PRECAUÇÕES
Aumento da mortalidade em pacientes idosos com psicose relacionada à demência
Os medicamentos antipsicóticos aumentam o risco de morte por todas as causas em pacientes idosos com psicose relacionada à demência. Análises de 17 ensaios clínicos controlados por placebo, com psicose relacionada à demência (duração modal de 10 semanas e em grande parte em pacientes em tratamento atípico) antipsicóticos) revelou um risco de morte nos pacientes tratados com drogas entre 1,6 e 1,7 vezes o risco nos pacientes tratados com placebo. Ao longo de um típico estudo controlado de 10 semanas, a taxa de mortalidade em pacientes tratados com drogas foi de cerca de 4,5%, em comparação com uma taxa de cerca de 2,6% em pacientes tratados com placebo.
Embora as causas da morte tenham variado, a maioria das mortes parecia ser de natureza cardiovascular (por exemplo, insuficiência cardíaca, morte súbita) ou infecciosa (por exemplo, pneumonia). O FANAPT não está aprovado para o tratamento de pacientes com psicose relacionada à demência.
Reações adversas cerebrovasculares, incluindo acidente vascular cerebral, em pacientes idosos com psicose relacionada à demência
Em ensaios controlados com placebo em idosos com demência, os pacientes randomizados para risperidona, aripiprazol e olanzapina apresentaram maior incidência de acidente vascular cerebral e ataque isquêmico transitório, incluindo acidente vascular encefálico. O FANAPT não está aprovado para o tratamento de pacientes com psicose relacionada à demência.
Prolongamento de QT
Em um estudo aberto de QTc em pacientes com esquizofrenia ou distúrbio esquizoafetivo (n = 160), o FANAPT foi associado a um prolongamento do intervalo QTc de 9 mseg a uma dose de 12 mg duas vezes por dia de iloperidona. O efeito de FANAPT no intervalo QT foi aumentado pela presença de inibição metabólica CYP450 2D6 ou 3A4 (paroxetina 20 mg uma vez ao dia e cetoconazol 200 mg duas vezes ao dia, respectivamente). Sob condições de inibição metabólica para 2D6 e 3A4, FANAPT 12 mg duas vezes ao dia foi associado a um aumento médio do QTcF a partir da linha de base de cerca de 19 ms.
Não foram observados casos de torsade de pointes ou outras arritmias cardíacas graves durante o programa clínico de pré-comercialização.
O uso de FANAPT deve ser evitado em combinação com outros medicamentos que prolongam o QTc, incluindo a Classe 1A (por exemplo, quinidina, procainamida). ou medicamentos antiarrítmicos de Classe III (por exemplo, amiodarona, sotalol), medicamentos antipsicóticos (por exemplo, clorpromazina, tioridazina), antibióticos (por exemplo, gatifloxacina, moxifloxacina) ou qualquer outra classe de medicamentos conhecida por prolongar o intervalo QTc (por exemplo, pentamidina, acetato de levometadil, metadona). O FANAPT também deve ser evitado em pacientes com síndrome do QT longo congênito e em pacientes com histórico de arritmias cardíacas.
Certas circunstâncias podem aumentar o risco de torsade de pointes e / ou morte súbita em associação com o uso de drogas que prolongam o intervalo QTc, incluindo (1) bradicardia; (2) hipocalemia ou hipomagnesemia; (3) uso concomitante de outros medicamentos que prolongam o intervalo QTc; e (4) presença de prolongamento congênito do intervalo QT; (5) infarto agudo do miocárdio recente; e / ou (6) insuficiência cardíaca não compensada.
É necessário cuidado ao prescrever o FANAPT com medicamentos que inibem o metabolismo do FANAPT e em pacientes com atividade reduzida do CYP2D6.
Recomenda-se que os pacientes considerados para tratamento com FANAPT correm risco de sofrer distúrbios eletrolíticos têm medições basais de potássio e magnésio no soro com periodicidade monitoramento. A hipocalemia (e / ou hipomagnesemia) pode aumentar o risco de prolongamento do intervalo QT e arritmia. O FANAPT deve ser evitado em pacientes com histórico de doença cardiovascular significativa, por exemplo, QT prolongamento, infarto agudo do miocárdio recente, insuficiência cardíaca descompensada ou arritmia cardíaca. O FANAPT deve ser descontinuado em pacientes com medições persistentes de QTc> 500 ms.
Se os pacientes que tomam FANAPT apresentarem sintomas que possam indicar a ocorrência de arritmias cardíacas, por exemplo, tonturas, palpitações ou síncope, o prescritor deve iniciar uma avaliação mais aprofundada, incluindo monitoramento.
Síndrome Maligno dos Neurolépticos (SNM)
Um complexo de sintomas potencialmente fatal, às vezes chamado de Síndrome Neuroléptica Maligna (SNM), foi relatado em associação com a administração de medicamentos antipsicóticos, incluindo o FANAPT. As manifestações clínicas incluem hiperpirexia, rigidez muscular, estado mental alterado (incluindo sinais catatônicos) e evidência de instabilidade autonômica (pulso ou pressão arterial irregular, taquicardia, diaforese e insuficiência cardíaca) disritmia). Sinais adicionais podem incluir creatina fosfoquinase elevada, mioglobinúria (rabdomiólise) e insuficiência renal aguda. A avaliação diagnóstica de pacientes com essa síndrome é complicada. Para chegar ao diagnóstico, é importante identificar os casos em que a apresentação clínica inclui doença médica grave e sinais e sintomas extrapiramidais não tratados ou inadequadamente tratados (EPS). Outras considerações importantes no diagnóstico diferencial incluem toxicidade anticolinérgica central, insolação, febre de drogas e patologia do sistema nervoso central (SNC).
O manejo desta síndrome deve incluir: (1) descontinuação imediata dos antipsicóticos e outros medicamentos não essenciais à terapia concomitante, (2) tratamento sintomático intensivo e monitoramento médico e (3) tratamento de quaisquer problemas médicos sérios concomitantes para os quais estejam disponíveis tratamentos específicos. Não existe um consenso geral sobre regimes de tratamento farmacológico específicos para SMN.
Se um paciente necessitar de tratamento medicamentoso antipsicótico após a recuperação da SMN, a potencial reintrodução da terapia medicamentosa deve ser cuidadosamente considerada. O paciente deve ser cuidadosamente monitorado, pois foram relatadas recorrências de SMN.
Discinesia tardia
A discinesia tardia é uma síndrome que consiste em movimentos discinéticos potencialmente irreversíveis, involuntários, que podem se desenvolver em pacientes tratados com antipsicóticos. Embora a prevalência da síndrome pareça ser mais alta entre os idosos, principalmente mulheres idosas, é impossível dependem de estimativas de prevalência para prever, no início do tratamento antipsicótico, quais pacientes provavelmente desenvolverão o síndrome. Não se sabe se os medicamentos antipsicóticos diferem em seu potencial de causar discinesia tardia.
Acredita-se que o risco de desenvolver discinesia tardia e a probabilidade de se tornar irreversível aumentar conforme a duração do tratamento e a dose cumulativa total de antipsicóticos administrados aumenta. No entanto, a síndrome pode se desenvolver, embora muito menos comumente, após períodos de tratamento relativamente breves em doses baixas.
Não há tratamento conhecido para casos estabelecidos de discinesia tardia, embora a síndrome possa remitir, parcial ou completamente, se o tratamento antipsicótico for suspenso. O próprio tratamento antipsicótico, no entanto, pode suprimir (ou suprimir parcialmente) os sinais e sintomas da síndrome e, assim, possivelmente mascarar o processo subjacente. O efeito que a supressão sintomática exerce sobre o curso da síndrome a longo prazo é desconhecido.
Dadas essas considerações, o FANAPT deve ser prescrito de maneira que seja mais provável minimizar a ocorrência de discinesia tardia. O tratamento antipsicótico crônico geralmente deve ser reservado para pacientes que sofrem de uma doença crônica que (1) é conhecida por responder a antipsicóticos e (2) para os quais não existem tratamentos alternativos, igualmente eficazes, mas potencialmente menos prejudiciais apropriado. Nos pacientes que necessitam de tratamento crônico, deve-se buscar a menor dose e a menor duração do tratamento, produzindo uma resposta clínica satisfatória. A necessidade de tratamento continuado deve ser reavaliada periodicamente.
Se sinais e sintomas de discinesia tardia aparecerem em um paciente em uso de FANAPT, a descontinuação do medicamento deve ser considerada. No entanto, alguns pacientes podem necessitar de tratamento com FANAPT, apesar da presença da síndrome.
Alterações metabólicas
Os antipsicóticos atípicos têm sido associados a alterações metabólicas que podem aumentar o risco cardiovascular / cerebrovascular. Essas alterações metabólicas incluem hiperglicemia, dislipidemia e ganho de peso corporal. Embora todos os medicamentos antipsicóticos atípicos demonstrem produzir algumas alterações metabólicas, cada medicamento da classe tem seu próprio perfil de risco específico.
Hiperglicemia e Diabetes Mellitus
Foi relatada hiperglicemia, em alguns casos extrema e associada a cetoacidose ou coma ou morte hiperosmolar, em pacientes tratados com antipsicóticos atípicos, incluindo o FANAPT. A avaliação da relação entre uso antipsicótico atípico e anormalidades da glicose é complicada pela possibilidade de um aumento risco de diabetes mellitus em pacientes com esquizofrenia e aumento da incidência de diabetes mellitus em geral população. Diante desses fatores de confusão, a relação entre uso antipsicótico atípico e eventos adversos relacionados à hiperglicemia não é completamente compreendida. No entanto, estudos epidemiológicos sugerem um risco aumentado de eventos adversos relacionados à hiperglicemia em pacientes tratados com antipsicóticos atípicos incluídos nesses estudos.
Pacientes com um diagnóstico estabelecido de diabetes mellitus iniciado com antipsicóticos atípicos devem ser monitorados regularmente para piorar o controle da glicose. Pacientes com fatores de risco para diabetes mellitus (por exemplo, obesidade, histórico familiar de diabetes) que estão iniciando o tratamento com antipsicóticos atípicos devem ser submetidos a testes de glicemia em jejum no início do tratamento e periodicamente durante tratamento. Qualquer paciente tratado com antipsicóticos atípicos deve ser monitorado quanto a sintomas de hiperglicemia, incluindo polidipsia, poliúria, polifagia e fraqueza. Pacientes que desenvolvem sintomas de hiperglicemia durante o tratamento com antipsicóticos atípicos devem ser submetidos a testes de glicemia em jejum. Em alguns casos, a hiperglicemia foi resolvida quando o antipsicótico atípico foi descontinuado; no entanto, alguns pacientes exigiram a continuação do tratamento antidiabético, apesar da descontinuação do medicamento suspeito.
Os dados de um estudo de dose fixa de 4 semanas em indivíduos adultos com esquizofrenia, no qual foram coletadas amostras de sangue em jejum, são apresentados na Tabela 1.

Análises agrupadas de dados de glicose de estudos clínicos, incluindo ensaios de longo prazo, são mostradas na Tabela2.

Dislipidemia
Alterações indesejáveis nos lipídios foram observadas em pacientes tratados com antipsicóticos atípicos.
Os dados de um estudo de dose fixa de 4 semanas, controlado por placebo, no qual foram coletadas amostras de sangue em jejum, em indivíduos adultos com esquizofrenia, são apresentados na Tabela 3.

As análises agrupadas dos dados de colesterol e triglicerídeos de estudos clínicos, incluindo ensaios de longo prazo, são mostradas na Tabela 4 e na Tabela 5.


Ganho de peso
O ganho de peso foi observado com o uso antipsicótico atípico. Recomenda-se o monitoramento clínico do peso.
Em todos os estudos de curto e longo prazo, a alteração média geral da linha de base no ponto final foi de 2,1 kg.
Alterações no peso corporal (kg) e na proporção de indivíduos com ganho ≥7% no peso corporal a partir de 4 são apresentados estudos de dose fixa ou flexível de 4 ou 6 semanas, controlados por placebo, em indivíduos adultos Quadro 6

Convulsões
Em estudos de curta duração controlados por placebo (4 a 6 semanas), ocorreram convulsões em 0,1% (1/1344) dos pacientes tratados com FANAPT em comparação com 0,3% (2/587) do placebo. Como com outros antipsicóticos, o FANAPT deve ser usado com cautela em pacientes com histórico de convulsões ou com condições que potencialmente diminuam o limiar convulsivo. Condições que diminuem o limiar convulsivo podem ser mais prevalentes em uma população de 65 anos ou mais.
Hipotensão ortostática e síncope
O FANAPT pode induzir hipotensão ortostática associada a tonturas, taquicardia e síncope. Isso reflete suas propriedades antagonistas alfa1-adrenérgicas. Em estudos de curta duração, controlados por placebo, em dupla ocultação, em que a dose foi aumentada lentamente, conforme recomendado acima, foi relatada síncope em 0,4% (5/1344) dos pacientes tratados com FANAPT, em comparação com 0,2% (1/587) na placebo. Foi relatada hipotensão ortostática em 5% dos pacientes que receberam 20-24 mg / dia, 3% dos pacientes que receberam 10-16 mg / dia e 1% dos pacientes que receberam placebo. Espera-se que uma titulação mais rápida aumente a taxa de hipotensão ortostática e síncope.
O FANAPT deve ser usado com cautela em pacientes com doença cardiovascular conhecida (por exemplo, insuficiência cardíaca, histórico de infarto do miocárdio, isquemia ou condução anormalidades), doença cerebrovascular ou condições que predispõem o paciente a hipotensão (desidratação, hipovolemia e tratamento com anti-hipertensivos medicamentos). O monitoramento dos sinais vitais ortostáticos deve ser considerado em pacientes vulneráveis à hipotensão.
Leucopenia, neutropenia e agranulocitose
Nos ensaios clínicos e na experiência pós-comercialização, foram notificados eventos de leucopenia / neutropenia temporalmente relacionados com agentes antipsicóticos. Agranulocitose (incluindo casos fatais) também foi relatada.
Os possíveis fatores de risco para leucopenia / neutropenia incluem baixa contagem de glóbulos brancos (WBC) preexistente e histórico de leucopenia / neutropenia induzida por drogas. Pacientes com um baixo leucograma pré-existente ou com histórico de leucopenia / neutropenia induzida por medicamentos devem ter seu hemograma completo (CBC) monitorado frequentemente durante os primeiros meses de terapia e deve interromper o FANAPT ao primeiro sinal de um declínio no leucograma na ausência de outros fatores causais. fatores.
Pacientes com neutropenia devem ser cuidadosamente monitorados quanto a febre ou outros sintomas ou sinais de infecção e tratados imediatamente se esses sintomas ou sinais ocorrerem. Pacientes com neutropenia grave (contagem absoluta de neutrófilos <1000 / mm3) devem interromper o FANAPT e seguir o seu leucograma até a recuperação.
Hiperprolactinemia
Tal como acontece com outros medicamentos que antagonizam os receptores da dopamina D2, o FANAPT eleva os níveis de prolactina.
A hiperprolactinemia pode suprimir a GnRH hipotalâmica, resultando em secreção reduzida de gonadotrofina hipofisária. Por sua vez, isso pode inibir a função reprodutiva, prejudicando a gonadalsteroidogênese em pacientes do sexo feminino e masculino. Galactorréia, amenorréia, ginecomastia e impotência foram relatadas com compostos que elevam a prolactina. A hiperprolactinemia de longa data, quando associada ao hipogonadismo, pode levar à diminuição da densidade óssea em pacientes do sexo feminino e masculino.
Experiências de cultura de tecidos indicam que aproximadamente um terço dos cânceres de mama humanos são dependentes de prolactina in vitro, um fator de importância potencial se a prescrição desses medicamentos for contemplada em um paciente com mama previamente detectada Câncer. Alterações proliferativas da glândula mamária e aumento da prolactina sérica foram observados em camundongos e ratos tratados com FANAPT. Nem os estudos clínicos nem os epidemiológicos realizados até o momento mostraram associação entre a administração crônica dessa classe de medicamentos e a tumorigênese em humanos; a evidência disponível é considerada muito limitada para ser conclusiva no momento.
Num ensaio de curta duração controlado por placebo (4 semanas), a alteração média da linha de base para o ponto final nos níveis plasmáticos de prolactina no grupo tratado com 24 mg / dia de FANAPT houve um aumento de 2,6 ng / mL em comparação com uma diminuição de 6,3 ng / mL no grupo placebo. Neste estudo, foram observados níveis plasmáticos elevados de prolactina em 26% dos adultos tratados com FANAPT em comparação com 12% no grupo placebo. Nos ensaios de curto prazo, o FANAPT foi associado a níveis modestos de elevação da prolactina em comparação com maiores elevações da prolactina observadas com alguns outros agentes antipsicóticos. Em análises agrupadas de estudos clínicos, incluindo ensaios de longo prazo, em 3210 adultos tratados com iloperidona, foi relatada ginecomastia em 2 indivíduos do sexo masculino (0,1%) em comparação com 0% em pacientes tratados com placebo, e galactorréia foi relatada em 8 indivíduos do sexo feminino (0,2%) em comparação com 3 indivíduos do sexo feminino (0,5%) em pacientes tratados com placebo pacientes.
Regulação da temperatura corporal
A interrupção da capacidade do corpo de reduzir a temperatura corporal central foi atribuída aos agentes antipsicóticos. Recomenda-se cuidados adequados ao prescrever o FANAPT para pacientes que sofrerão condições que podem contribuir para uma elevação no núcleo do corpo temperatura, por exemplo, exercitar-se vigorosamente, exposição a calor extremo, receber medicação concomitante com atividade anticolinérgica ou estar sujeito a desidratação.
Disfagia
Dismotilidade e aspiração esofágicas têm sido associadas ao uso de drogas antipsicóticas. A pneumonia aspirativa é uma causa comum de morbimortalidade em pacientes idosos. O FANAPT e outros medicamentos antipsicóticos devem ser usados com cautela em pacientes com risco de pneumonia aspirativa.
Suicídio
A possibilidade de uma tentativa de suicídio é inerente à doença psicótica, e a supervisão rigorosa de pacientes de alto risco deve acompanhar a terapia medicamentosa. As prescrições para FANAPT devem ser escritas para a menor quantidade de comprimidos, consistente com o bom gerenciamento do paciente, a fim de reduzir o risco de overdose.
Priapismo
Três casos de priapismo foram relatados no programa FANAPT pré-marketing. Foi relatado que drogas com efeitos de bloqueio alfa-adrenérgico induzem priapismo. A FANAPT compartilha essa atividade farmacológica. O priapismo grave pode exigir intervenção cirúrgica.
Potencial de comprometimento cognitivo e motor
O FANAPT, como outros antipsicóticos, tem o potencial de prejudicar o julgamento, o pensamento ou as habilidades motoras. Em estudos de curto prazo controlados por placebo, foi relatada sonolência (incluindo sedação) em 11,9% (104/874) dos doentes adultos tratados com FANAPT em doses iguais ou superiores a 10 mg / dia versus 5,3% (31/587) tratados com placebo. Os pacientes devem ser advertidos sobre a operação de máquinas perigosas, incluindo automóveis, até que estejam razoavelmente certos de que a terapia com o FANAPT não os afeta adversamente.
topo
Reações adversas
Experiência em Estudos Clínicos
Como os ensaios clínicos são conduzidos sob condições amplamente variadas, as taxas de reação adversa observadas no ensaio clínico de um medicamento não pode ser diretamente comparado às taxas dos ensaios clínicos de outro medicamento e pode não refletir as taxas observadas nos prática. As informações abaixo são derivadas de um banco de dados de ensaios clínicos do FANAPT que consiste em 3229 pacientes expostos ao FANAPT em doses de 10 mg / dia ou mais, para o tratamento da esquizofrenia. Desses, 999 receberam o FANAPT por pelo menos 6 meses, com 657 expostos ao FANAPT por pelo menos 12 meses. Todos esses pacientes que receberam FANAPT estavam participando de ensaios clínicos de doses múltiplas. As condições e a duração do tratamento com FANAPT variaram bastante e incluíram (em categorias sobrepostas), rótulo aberto e fases duplo-cego de estudos, pacientes internados e ambulatoriais, estudos de dose fixa e flexível e estudos de curto e longo prazo exposição.
As informações apresentadas nestas seções foram derivadas de dados agrupados de 4 pacientes controlados por placebo, 4 ou 6 semanas, estudos de dose fixa ou flexível em pacientes que receberam FANAPT em doses diárias dentro de um intervalo de 10 a 24 mg (n = 874).
Reações adversas que ocorrem com uma incidência de 2% ou mais entre pacientes tratados com FANAPT e mais frequentes que o placebo
A Tabela 7 enumera as incidências combinadas de reações adversas que foram relatadas espontaneamente em quatro semanas, 4 ou 6 semanas, controladas por placebo, estudos de dose fixa ou flexível, listando as reações que ocorreram em 2% ou mais dos pacientes tratados com FANAPT em qualquer dose grupos e para os quais a incidência em pacientes tratados com FANAPT em qualquer grupo de doses foi maior que a incidência em pacientes tratados com placebo.

Reações adversas relacionadas à dose em ensaios clínicos
Com base nos dados agrupados de 4 estudos controlados por placebo, de 4 ou 6 semanas, em dose fixa ou flexível, reações adversas que ocorreram com mais de 2% incidência nos pacientes tratados com FANAPT e cuja incidência em pacientes tratados com FANAPT 20-24 mg / dia foi duas vezes maior que a incidência em os pacientes tratados com FANAPT 10-16 mg / dia foram: desconforto abdominal, tontura, hipotensão, rigidez musculoesquelética, taquicardia e peso aumentado.
Reações adversas comuns e relacionadas a medicamentos em ensaios clínicos
Com base nos dados agrupados de 4 estudos controlados por placebo, de 4 ou 6 semanas, em dose fixa ou flexível, as seguintes reações adversas ocorreram em ≥5% de incidência nos pacientes tratados com FANAPT e pelo menos duas vezes o placebo placebo e por pelo menos 1 dose: tontura, boca seca, fadiga, congestão nasal, sonolência, taquicardia, hipotensão ortostática e peso aumentado. Tonturas, taquicardia e aumento de peso foram pelo menos duas vezes mais comuns em 20-24 mg / dia do que em 10-16 mg / dia.
Sintomas extrapiramidais (EPS) em ensaios clínicos
Os dados reunidos dos 4 estudos controlados por placebo, de 4 a 6 semanas, em doses fixas ou flexíveis, forneceram informações sobre EPS. Os dados de eventos adversos coletados nesses ensaios mostraram as seguintes taxas de eventos adversos relacionados ao EPS, como mostrado na Tabela 8.

Reações adversas associadas à descontinuação do tratamento em ensaios clínicos
Com base nos dados agrupados de 4 estudos controlados por placebo, de 4 ou 6 semanas, de dose fixa ou flexível, não houve diferença na incidência de descontinuação devido a eventos adversos entre FANAPT (5%) e placebo (5%) pacientes. Os tipos de eventos adversos que levaram à descontinuação foram semelhantes nos pacientes tratados com FANAPT e com placebo.
Diferenças demográficas nas reações adversas em ensaios clínicos
Um exame de subgrupos populacionais nos 4 grupos controlados por placebo, de 4 ou 6 semanas, fixos ou estudos de doses flexíveis não revelaram evidências de diferenças de segurança com base na idade, sexo ou raça.
Anormalidades em exames laboratoriais em ensaios clínicos
Não houve diferenças entre FANAPT e placebo na incidência de descontinuação devido a alterações na hematologia, exame de urina ou química sérica.
Em estudos de curta duração controlados por placebo (4 a 6 semanas), houve 1,0% (13/1342) de pacientes tratados com iloperidona com hematócrito pelo menos uma vez abaixo da faixa normal estendida durante o tratamento pós-randomização, comparado a 0,3% (2/585) placebo. O intervalo normal estendido para hematócrito reduzido foi definido em cada um desses ensaios como o valor 15% abaixo do intervalo normal para o laboratório centralizado que foi usado no ensaio.
Outras reações durante a avaliação pré-comercialização do FANAPT
A seguir, é apresentada uma lista de termos do MedDRA que refletem reações adversas em pacientes tratados com FANAPT em doses múltiplas ≥ 4 mg / dia durante qualquer fase de um estudo com o banco de dados de 3210 tratados com FANAPT pacientes. Todas as reações relatadas estão incluídas, exceto as já listadas na Tabela 7, ou outras partes das Reações adversas (6), aquelas consideradas na Advertências e Precauções (5), os termos de reação que eram tão gerais a ponto de não informativos, reações relatadas em menos de 3 pacientes e que não eram graves nem ameaçadoras à vida, reações que são comuns como reações de fundo e reações consideradas improváveis de serem drogas relacionados.
As reações são categorizadas adicionalmente pela classe de órgãos do sistema MedDRA e listadas em ordem decrescente de frequência, de acordo com o seguinte definições: eventos adversos frequentes são aqueles que ocorrem em pelo menos 1/100 pacientes (apenas aqueles não listados na Tabela 7 aparecem neste listagem); reações adversas infreqüentes são aquelas que ocorrem em 1/100 a 1/1000 pacientes; eventos raros são aqueles que ocorrem em menos de 1/1000 pacientes.
Distúrbios sanguíneos e linfáticos: infreqüente - anemia, anemia por deficiência de ferro; Leucopenia rara
Distúrbios cardíacos: Frequentes - palpitações; Raros - arritmia, bloqueio atrioventricular de primeiro grau, insuficiência cardíaca (incluindo congestiva e aguda)
Distúrbios do ouvido e do labirinto: infreqüente - vertigem, zumbido
Distúrbios endócrinos: infreqüente - hipotireoidismo
Afecções oculares: Frequentes - conjuntivite (incluindo alérgicas); Pouco frequentes - olho seco, blefarite, edema palpebral, inchaço dos olhos, opacidades lenticulares, catarata, hiperemia (incluindo conjuntival)
Distúrbios gastrointestinais: infreqüentes - gastrite, hipersecreção salivar, incontinência fecal, ulceração bucal; Raros - estomatite aftosa, úlcera duodenal, hérnia de hiato, hipocloridria, ulceração labial, esofagite de refluxo, estomatite
Distúrbios gerais e condições do local administrativo: Infreqüente - edema (geral, pontilhado, devido a doença cardíaca), dificuldade em caminhar, sede; Raros - hipertermia
Distúrbios hepatobiliares: infreqüentes - colelitíase
Investigações: Frequentes: peso diminuído; Infreqüente - hemoglobina diminuída, contagem de neutrófilos aumentada, hematócrito diminuído
Distúrbios do metabolismo e da nutrição: pouco frequentes - aumento do apetite, desidratação, hipocalemia, retenção de líquidos
Perturbações músculo-esqueléticas e dos tecidos conjuntivos: Frequentes - mialgia, espasmos musculares; Raro - torcicolo
Distúrbios do sistema nervoso: Infreqüente - parestesia, hiperatividade psicomotora, inquietação, amnésia, nistagmo; Síndrome das pernas inquietas raras
Transtornos Psiquiátricos: Frequentes - inquietação, agressão, ilusão; Infreqüente - hostilidade, diminuição da libido, paranóia, anorgasmia, estado confusional, mania, catatonia, alterações de humor, pânico ataque, distúrbio obsessivo-compulsivo, bulimia nervosa, delírio, polidipsia psicogênica, distúrbio de controle de impulsos, depressão
Distúrbios renais e urinários: incontinência urinária frequente; Infreqüente - disúria, pollakiuria, enurese, nefrolitíase; Raros - retenção urinária, insuficiência renal aguda
Sistema reprodutivo e distúrbios da mama: disfunção erétil freqüente; Infrequen - dor testicular, amenorréia, dor no peito; Raros - menstruação irregular, ginecomastia, menorragia, metrorragia, hemorragia pós-menopáusica, prostatite.
Distúrbios respiratórios, torácicos e do mediastino: infreqüentes - epistaxe, asma, rinorréia, congestão nasal, secura nasal; Raros - garganta seca, síndrome da apneia do sono, dispnéia por esforço
Experiência pós-comercialização
As seguintes reações adversas foram identificadas durante o uso pós-aprovação de FANAPT: ejaculação retrógrada e reações de hipersensibilidade (incluindo anafilaxia; angioedema; aperto na garganta; inchaço orofaríngeo; inchaço da face, lábios, boca e língua; urticária; erupção cutânea; e prurido). Como essas reações foram relatadas voluntariamente em uma população de tamanho incerto, não é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
topo
Interações medicamentosas
Dados os efeitos primários do FANAPT no SNC, deve-se ter cautela quando tomado em combinação com outros medicamentos e álcool de ação central. Devido ao seu antagonismo do receptor alfa1-adrenérgico, o FANAPT tem o potencial de aumentar o efeito de certos agentes anti-hipertensivos.
Potencial para outros medicamentos afetarem o FANAPT
A iloperidona não é um substrato para as enzimas CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19 ou CYP2E1. Isso sugere que é improvável uma interação da iloperidona com inibidores ou indutores dessas enzimas, ou outros fatores, como o fumo. O CYP3A4 e o CYP2D6 são responsáveis pelo metabolismo da iloperidona. Inibidores do CYP3A4 (por exemplo, cetoconazol) ou CYP2D6 (por exemplo, fluoxetina, paroxetina) podem inibir a eliminação de iloperidona e causar níveis sanguíneos aumentados.
Cetoconazol: coadministração de cetoconazol (200 mg duas vezes ao dia por 4 dias), um potente inibidor do CYP3A4, com uma dose única de 3 mg de iloperidona até 19 voluntários saudáveis, com idades entre 18 e 45 anos, aumentaram a área sob a curva (AUC) da iloperidona e seus metabólitos P88 e P95 em 57%, 55% e 35%, respectivamente. As doses de iloperidona devem ser reduzidas em cerca de metade quando administradas com cetoconazol ou outros inibidores fortes do CYP3A4 (por exemplo, itraconazol). Inibidores mais fracos (por exemplo, eritromicina, suco de toranja) não foram estudados. Quando o inibidor do CYP3A4 é retirado da terapia combinada, a dose de iloperidona deve retornar ao nível anterior.
Fluoxetina: Coadministração de fluoxetina (20 mg duas vezes ao dia por 21 dias), um potente inibidor do CYP2D6, com uma dose única de 3 mg de iloperidona a 23 voluntários saudáveis, com idades entre 29 e 44 anos, que foram classificados como metabolizadores extensos do CYP2D6, aumentaram a AUC da iloperidona e seu metabolito P88 em cerca de 2 a 3 vezes e diminuíram a AUC do seu metabólito P95 em uma metade. As doses de iloperidona devem ser reduzidas pela metade quando administradas com fluoxetina. Quando a fluoxetina é retirada da terapia combinada, a dose de iloperidona deve retornar ao nível anterior. Espera-se que outros inibidores fortes do CYP2D6 tenham efeitos semelhantes e precisem de reduções de dose apropriadas. Quando o inibidor da CYP2D6 é retirado da terapia combinada, a dose de iloperidona pode então ser aumentada para o nível anterior.
Paroxetina: Coadministração de paroxetina (20 mg / dia por 5-8 dias), um potente inibidor do CYP2D6, com doses múltiplas de iloperidona (8). 12 mg duas vezes ao dia) em pacientes com esquizofrenia com idades entre 18 e 65 anos, resultaram em aumento das concentrações médias médias a iloperidona e seu metabólito P88, em cerca de 1,6 vezes, e diminuíram as concentrações máximas médias no estado estacionário de seu metabolito P95 em uma metade. As doses de iloperidona devem ser reduzidas pela metade quando administradas com paroxetina. Quando a paroxetina é retirada da terapia combinada, a dose de iloperidona deve retornar ao nível anterior. Espera-se que outros inibidores fortes do CYP2D6 tenham efeitos semelhantes e precisem de reduções de dose apropriadas. Quando o inibidor da CYP2D6 é retirado da terapia combinada, a dose de iloperidona pode então ser aumentada para níveis anteriores.
Paroxetina e cetoconazol: co-administração de paroxetina (20 mg uma vez ao dia por 10 dias), um inibidor da CYP2D6 e cetoconazol (200 mg duas vezes ao dia) com doses múltiplas de iloperidona (8 ou 12 mg duas vezes ao dia) a pacientes com esquizofrenia com idades entre 18 e 65 anos, resultou em um aumento de 1,4 aumento de vezes nas concentrações em estado estacionário da iloperidona e do seu metabolito P88 e uma diminuição de 1,4 vezes no P95 na presença de paroxetina. Portanto, administrar iloperidona com inibidores de ambas as suas vias metabólicas não aumentou o efeito de nenhum dos inibidores administrados isoladamente. As doses de iloperidona devem, portanto, ser reduzidas em cerca de metade se administradas concomitantemente com um inibidor do CYP2D6 e do CYP3A4.
Potencial para a FANAPT afetar outros medicamentos
Estudos in vitro em microssomas hepáticos humanos mostraram que a iloperidona não inibe substancialmente o metabolismo de drogas metabolizadas pelas seguintes isozimas do citocromo P450: CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9 ou CYP2E1. Além disso, estudos in vitro em microssomas hepáticos humanos mostraram que a iloperidona não possui enzimas indutoras de enzimas. propriedades, especificamente para as seguintes isozimas do citocromo P450: CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP3A4 e CYP3A5.
Dextrometorfano: Um estudo em voluntários saudáveis mostrou que alterações na farmacocinética do dextrometorfano (dose de 80 mg) quando uma dose de 3 mg de A administração concomitante de iloperidona resultou em um aumento de 17% na exposição total e de 26% nas concentrações plasmáticas máximas C max de dextrometorfano. Assim, é improvável uma interação entre a iloperidona e outros substratos do CYP2D6.
Fluoxetina: Uma dose única de 3 mg de iloperidona não teve efeito na farmacocinética da fluoxetina (20 mg duas vezes ao dia).
Midazolam (um substrato sensível do CYP 3A4): um estudo em pacientes com esquizofrenia mostrou um aumento de menos de 50% no total de midazolam exposição no estado estacionário de iloperidona (14 dias de administração oral de até 10 mg de iloperidona duas vezes ao dia) e nenhum efeito no midazolam C máx. Assim, é improvável uma interação entre a iloperidona e outros substratos do CYP3A4.
Medicamentos que prolongam o intervalo QT O FANAPT não deve ser utilizado com outros medicamentos que prolongam o intervalo QT.
topo
Use em populações específicas
Registro de Exposição à Gravidez
Existe um registro de exposição à gravidez que monitora os resultados da gravidez em mulheres expostas ao FANAPT durante a gravidez. Para obter mais informações, entre em contato com o Registro Nacional de Gravidez para Antipsicóticos Atípicos em 1-866-961-2388 ou visite http://womensmentalhealth.org/clinical-and programas de pesquisa / registro de gravidez /.
Resumo do Risco
Os neonatos cujas mães são expostas a medicamentos antipsicóticos, incluindo o FANAPT, durante o terceiro trimestre de gravidez correm risco de sintomas extrapiramidais e / ou de abstinência após o parto. Os limitados dados disponíveis com o FANAPT em mulheres grávidas não são suficientes para informar o risco associado a medicamentos para defeitos congênitos graves e aborto. A iloperidona não era teratogênica quando administrada por via oral a ratos prenhes durante a organogênese em doses até 26 vezes a dose humana máxima recomendada de 24 mg / dia em mg / m2. No entanto, prolongou a duração da gravidez e do parto, aumentou o número de nascidos mortos, mortes intra-uterinas precoces, aumentou a incidência de atrasos no desenvolvimento e diminuiu a sobrevivência dos filhotes no pós-parto. A iloperidona não era teratogênica quando administrada por via oral a coelhos prenhes durante a organogênese em doses de até 20 vezes o MRHD em mg / m2. No entanto, aumentou as mortes intra-uterinas precoces e diminuiu a viabilidade fetal a termo na dose mais alta, que também era uma dose tóxica materna.
O risco histórico de defeitos congênitos graves e aborto espontâneo para a população indicada é desconhecido. Na população geral dos EUA, o risco de fundo estimado de grandes defeitos congênitos e aborto em gestações clinicamente reconhecidas é de 2-4% e 15-20%, respectivamente.
Considerações clínicas
Reações adversas fetais / neonatais
Sintomas extrapiramidais e / ou de abstinência, incluindo agitação, hipertonia, hipotonia, tremor, sonolência, sofrimento irritativo e distúrbios alimentares foram relatados em neonatos cujas mães foram expostas a antipsicóticos durante o terceiro trimestre de gravidez. Esses sintomas variam em gravidade. Alguns neonatos se recuperaram em poucas horas ou dias sem tratamento específico; outros exigiram hospitalização prolongada. Monitore os neonatos quanto a sintomas extrapiramidais e / ou de abstinência e gerencie os sintomas adequadamente.
Dados
Dados de Animais
Em um estudo de desenvolvimento embrião-fetal, as ratas prenhes receberam 4, 16 ou 64 mg / kg / dia (1,6, 6,5 e 26 vezes a dose humana máxima recomendada (MRHD) de 24 mg / dia, em mg / m2) de iloperidona por via oral durante o período de organogênese. A dose mais alta causou aumento das mortes intra-uterinas precoces, diminuição do peso e comprimento fetais, diminuição da ossificação esquelética fetal e aumento da incidência de anomalias esqueléticas fetais menores e variações; esta dose também causou diminuição do consumo de alimentos maternos e ganho de peso.
Em um estudo de desenvolvimento embrionário-fetal, coelhos prenhes receberam 4, 10 ou 25 mg / kg / dia (3, 8 e 20 vezes o MRHD em mg / m2) de iloperidona durante o período de organogênese. A dose mais alta causou aumento das mortes intra-uterinas precoces e diminuição da viabilidade fetal a termo; esta dose também causou toxicidade materna.
Em estudos adicionais nos quais os ratos receberam iloperidona em doses semelhantes às anteriores, começando pela pré-concepção ou pela dia 17 da gestação e continuação do desmame, os efeitos adversos na reprodução incluíram gravidez e parto prolongados, aumento da taxas de natimortos, aumento da incidência de variações viscerais fetais, diminuição dos pesos fetais e de filhotes e diminuição de filhotes pós-parto sobrevivência. Não houve efeitos de drogas no desenvolvimento neurocomportamental ou reprodutivo dos filhotes sobreviventes. As doses sem efeito variaram de 4 a 12 mg / kg, exceto pelo aumento nas taxas de natimortos que ocorreram na dose mais baixa testada de 4 mg / kg, que é 1,6 vezes o MRHD em mg / m2. A toxicidade materna foi observada nas doses mais altas nesses estudos.
O metabolito da iloperidona P95, que é o principal metabólito circulante da iloperidona em humanos, mas não está presente no quantidades significativas em ratos, foi administrado a ratas prenhes durante o período de organogênese em doses orais de 20, 80 ou 200 mg kg / dia. Não foram observados efeitos teratogênicos. Ossificação esquelética tardia ocorreu em todas as doses. Nenhuma toxicidade materna significativa foi produzida. Os níveis plasmáticos de P95 (AUC) na dose mais alta testada foram 2 vezes os níveis em humanos que receberam o MRHD de iloperidona.
Lactação
Resumo do Risco
Não existe informação sobre a presença de iloperidona ou dos seus metabolitos no leite humano, a efeitos da iloperidona em uma criança amamentada, nem os efeitos da iloperidona no leite humano Produção. A iloperidona está presente no leite de rato. Devido ao potencial de reações adversas graves em crianças amamentadas, aconselhe uma mulher a não amamentar durante o tratamento com FANAPT.
Dados A transferência de radioatividade para o leite de ratos lactantes foi investigada após uma dose única de [14C] iloperidona a 5 mg / kg. A concentração de radioatividade no leite 4 horas após a dose foi quase 10 vezes maior que a do plasma ao mesmo tempo. No entanto, 24 horas após a administração, as concentrações de radioatividade no leite caíram para valores ligeiramente inferiores ao plasma. O perfil metabólico no leite foi qualitativamente semelhante ao do plasma.
Uso pediátrico A segurança e a eficácia em pacientes pediátricos e adolescentes não foram estabelecidas.
Uso Geriátrico
Os estudos clínicos de FANAPT no tratamento da esquizofrenia não incluíram número suficiente de pacientes com 65 anos ou mais para determinar se eles respondem ou não de maneira diferente dos adultos mais jovens pacientes. Dos 3210 pacientes tratados com FANAPT em estudos de pré-comercialização, 25 (0,5%) tinham idade ≥65 anos e não havia pacientes ≥75 anos.
Pacientes idosos com psicose relacionada à demência tratados com FANAPT têm um risco aumentado de morte em comparação com o placebo. O FANAPT não está aprovado para o tratamento de pacientes com psicose relacionada à demência.
Insuficiência renal
Como o FANAPT é altamente metabolizado, com menos de 1% do fármaco excretado inalterado, é improvável que o comprometimento renal por si só tenha um impacto significativo na farmacocinética do FANAPT. O comprometimento renal (depuração da creatinina <30 mL / min) teve um efeito mínimo na Cmax da iloperidona (administrada em uma dose única de 3 mg) e em seus metabólitos P88 e P95 em qualquer um dos três analitos medidos. AUC0– ∞ aumentou 24%, diminuiu 6% e 52% para a iloperidona, P88 e P95, respectivamente, em indivíduos com insuficiência renal.
Compromisso hepático
Não é necessário ajuste da dose de FANAPT em doentes com compromisso hepático ligeiro. Pacientes com insuficiência hepática moderada podem precisar de redução da dose. FANAPT não é recomendado em doentes com compromisso hepático grave.
Em indivíduos adultos com compromisso hepático leve, não foi observada diferença relevante na farmacocinética da iloperidona, P88 ou P95 (total ou não ligada) em comparação com controles adultos saudáveis. Em indivíduos com insuficiência hepática moderada, uma exposição livre mais alta (2 vezes) e mais variável aos metabólitos ativos P88 foi observados em comparação com controles saudáveis, enquanto a exposição à iloperidona e P95 foi geralmente semelhante (menos de 50% de alteração em comparação com ao controle). Como não foi realizado um estudo em indivíduos com insuficiência hepática grave, o FANAPT não é recomendado para pacientes com insuficiência hepática grave.
Condição de fumante
Com base em estudos in vitro utilizando enzimas hepáticas humanas, o FANAPT não é um substrato para o CYP1A2; o tabagismo não deve, portanto, ter efeito sobre a farmacocinética do FANAPT.
Gravidez
topo
Abuso e dependência de drogas
Substância controlada
FANAPT não é uma substância controlada.
Abuso
O FANAPT não foi sistematicamente estudado em animais ou humanos por seu potencial de abuso, tolerância ou dependência física. Embora os ensaios clínicos não tenham revelado qualquer tendência ao comportamento de busca de drogas, essas observações não foram sistemáticas e não é possível prever, com base nessa experiência, até que ponto um medicamento ativo do SNC, o FANAPT, será mal utilizado, desviado e / ou abusado uma vez comercializado. Consequentemente, os pacientes devem ser avaliados cuidadosamente quanto a uma história de abuso de drogas e devem observados atentamente quanto a sinais de uso indevido ou abuso do FANAPT (por exemplo, desenvolvimento de tolerância, aumento da dose, procura de drogas comportamento).
topo
Sobredosagem
Experiência Humana
Nos ensaios de pré-comercialização que envolveram mais de 3210 pacientes, a overdose acidental ou intencional de FANAPT foi documentado em 8 pacientes, variando de 48 mg a 576 mg tomados de uma só vez e 292 mg tomados ao longo de 3 dias período. Nenhuma fatalidade foi relatada nesses casos. A maior ingestão confirmada de FANAPT foi de 576 mg; nenhum efeito físico adverso foi observado para esse paciente. A próxima maior ingestão confirmada de FANAPT foi de 438 mg durante um período de 4 dias; sintomas extrapiramidais e um intervalo QTc de 507 mseg foram relatados para esse paciente sem sequelas cardíacas. Este paciente retomou o tratamento com FANAPT por mais 11 meses.
Em geral, os sinais e sintomas relatados foram aqueles resultantes de um exagero dos efeitos farmacológicos conhecidos (por exemplo, sonolência e sedação, taquicardia e hipotensão) do FANAPT.
Gestão de Sobredosagem
Não há antídoto específico para o FANAPT. Portanto, medidas de suporte apropriadas devem ser instituídas. Em caso de sobredosagem aguda, o médico deve estabelecer e manter uma via aérea e garantir oxigenação e ventilação adequadas. A lavagem gástrica (após a intubação, se o paciente estiver inconsciente) e a administração de carvão ativado juntamente com um laxante devem ser consideradas. A possibilidade de obtundação, convulsões ou reação distônica da cabeça e pescoço após overdose pode criar risco de aspiração com êmese induzida. A monitorização cardiovascular deve começar imediatamente e deve incluir monitorização contínua de ECG para detectar possíveis arritmias. Se a terapia antiarrítmica for administrada, disopiramida, procainamida e quinidina não devem ser usadas, pois elas têm potencial para efeitos de prolongamento do intervalo QT que podem ser aditivos aos do FANAPT. Da mesma forma, é razoável esperar que as propriedades de bloqueio alfa do bretílio possam ser aditivas às do FANAPT, resultando em hipotensão problemática. Hipotensão e colapso circulatório devem ser tratados com medidas apropriadas, como fluidos intravenosos ou agentes simpatomiméticos (epinefrina e dopamina não devem ser usadas, pois a estimulação beta pode piorar a hipotensão no cenário de alfa alfa induzida por FANAPT bloqueio). Nos casos de sintomas extrapiramidais graves, deve ser administrada medicação anticolinérgica. A supervisão médica rigorosa deve continuar até o paciente se recuperar.
topo
Descrição
O FANAPT é um antipsicótico atípico pertencente à classe química dos derivados de piperidinil-benzisoxazol. Seu nome químico é 4 '- [3- [4- (6-Fluoro-1,2-benzisoxazol-3-il) piperidino] propoxi] -3’-metoxiacetofenona. Sua fórmula molecular é C24H27FN2O4 e seu peso molecular é 426,48. A fórmula estrutural é:
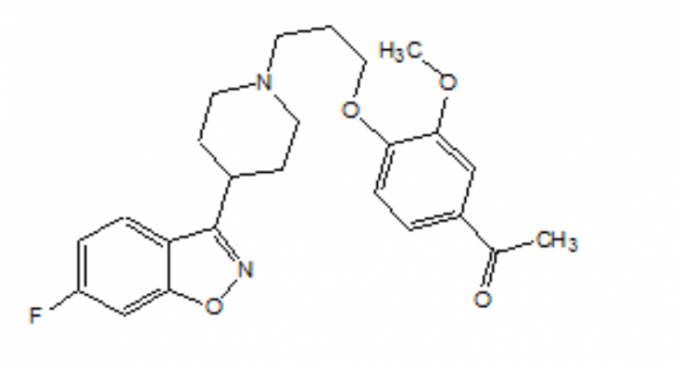
A iloperidona é um pó finamente cristalino branco a esbranquiçado. É praticamente insolúvel em água, muito pouco solúvel em HCl 0,1 N e livremente solúvel em clorofórmio, etanol, metanol e acetonitrila.
Os comprimidos de FANAPT destinam-se apenas a administração oral. Cada rodada, sem revestimento
O comprimido contém 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg ou 12 mg de iloperidona. Os ingredientes inativos são: lactose monohidratada, celulose microcristalina, hidroxipropilmetilcelulose, crospovidona, estearato de magnésio, silício coloidal
dióxido e água purificada (removida durante o processamento). Os comprimidos são brancos, redondos, planos, com bordas chanfradas e identificados com o logotipo “” gravado em um lado e força “1”, “2”, “4”, “6”, “8”, “10”, ou "12" gravado no outro lado.
topo
Farmacologia Clínica
Mecanismo de ação
O mecanismo de ação da iloperidona na esquizofrenia é desconhecido. Contudo, a eficácia da iloperidona pode ser mediada através de uma combinação de antagonismo da dopamina tipo 2 (D2) e serotonina tipo 2 (5-HT2).
A iloperidona forma um metabólito ativo, o P88, que possui um perfil de ligação ao receptor in vitro semelhante ao medicamento original.
Farmacodinâmica
A iloperidona atua como um antagonista com alta afinidade (nM) de ligação à serotonina 5-HT2A dopamina D2 e Receptores D3 e receptores norepinefrina NEα1 (valores de Ki de 5,6, 6,3, 7,1 e 0,36 nM, respectivamente). A iloperidona tem afinidade moderada pelos receptores dopamina D4 e serotonina 5-HT6 e 5 -HT7 (valores de Ki de 25, 43 e 22, nM respectivamente) e baixa afinidade para os receptores serotonina 5-HT1A, dopamina D1 e histamina H1 (valores de Ki de 168, 216 e 437 nM, respectivamente). A iloperidona não possui afinidade apreciável (Ki> 1000 nM) pelos receptores muscarínicos colinérgicos. A afinidade do metabólito da iloperidona P88 é geralmente igual ou menor que a do composto original, enquanto o metabolito P95 apenas mostra afinidade para 5-HT2A (valor de Ki de 3,91) e os receptores NEα1A, NEα1B, NEα1D e NEα2C (valores Ki de 4,7, 2,7, 8,8 e 4,7 nM respectivamente).
Farmacocinética
As semi-vidas médias de eliminação observadas da iloperidona, P88 e P95 nos metabolizadores extensos do CYP2D6 (EM) são 18, 26 e 23 horas, respectivamente, e em metabolizadores fracos (PM) são 33, 37 e 31 horas, respectivamente. As concentrações no estado estacionário são atingidas dentro de 3-4 dias após a administração. O acúmulo de iloperidona é previsível a partir da farmacocinética de dose única. A farmacocinética da iloperidona é mais do que proporcional à dose. A eliminação da iloperidona ocorre principalmente pelo metabolismo hepático, envolvendo 2 isozimas P450, CYP2D6 e CYP3A4.
Absorção: A iloperidona é bem absorvida após a administração do comprimido, com concentrações plasmáticas máximas ocorrendo dentro de 2 a 4 horas; enquanto a biodisponibilidade relativa da formulação do comprimido em comparação com a solução oral é de 96%. A administração de iloperidona com uma refeição rica em gordura padrão não afetou significativamente a Cmax ou a AUC de iloperidona, P88 ou P95, mas atrasou a Tmax em 1 hora para iloperidona, 2 horas para P88 e 6 horas para P95. O FANAPT pode ser administrado sem levar em consideração as refeições.
Distribuição: A iloperidona tem uma depuração aparente (depuração / biodisponibilidade) de 47 a 102 L / h, com um volume aparente de distribuição de 1340-2800 L. Em concentrações terapêuticas, a fração não ligada de iloperidona no plasma é de ~ 3% e de cada metabolito (P88 e P95) é de ~ 8%.
Metabolismo e eliminação: A iloperidona é metabolizada principalmente por 3 vias de biotransformação: redução de carbonila, hidroxilação (mediada por CYP2D6) e desmetilação de O (mediada por CYP3A4). Existem 2 metabolitos predominantes de iloperidona, P95 e P88. O metabolito da iloperidona P95 representa 47,9% da AUC da iloperidona e seus metabólitos no plasma no estado de equilíbrio para metabolizadores extensos (EM) e 25% para metabolizadores ruins (PM). O metabólito ativo P88 representa 19,5% e 34,0% da exposição plasmática total em EM e PM, respectivamente.
Aproximadamente 7% a 10% dos caucasianos e 3% a 8% dos negros / afro-americanos não têm capacidade de metabolizar o CYP2D6 substratos e são classificados como metabolizadores fracos (PM), enquanto os demais são intermediários, extensos ou ultra-rápidos metabolizadores. A administração concomitante de FANAPT com inibidores fortes conhecidos do CYP2D6 como a fluoxetina resulta em 2,3 vezes aumento da exposição plasmática à iloperidona e, portanto, metade da dose de FANAPT deve ser administrado.
Da mesma forma, as MPs do CYP2D6 têm maior exposição à iloperidona em comparação com os EMs e as MPs devem ter sua dose reduzida pela metade. Testes de laboratório estão disponíveis para identificar PMs do CYP2D6.
A maior parte dos materiais radioativos foi recuperada na urina (média de 58,2% e 45,1% em EM e PM, respectivamente), com as fezes representando 19,9% (EM) a 22,1% (PM) da radioatividade dosada.
Interação do transportador: Iloperidona e P88 não são substratos da P-gp e a iloperidona é um inibidor fraco da P-gp.
topo
Toxicologia Não Clínica
Carcinogênese, mutagênese, comprometimento da fertilidade
Carcinogênese: Estudos de carcinogenicidade ao longo da vida foram realizados em camundongos CD-1 e ratos Sprague Dawley. A iloperidona foi administrada por via oral nas doses de 2,5, 5,0 e 10 mg / kg / dia a camundongos CD-1 e 4, 8 e 16 mg / kg / dia a Ratos Sprague Dawley (0,5, 1,0 e 2,0 vezes e 1,6, 3,2 e 6,5 vezes, respectivamente, o MRHD de 24 mg / dia em mg / m2 base). Houve um aumento da incidência de tumores malignos da glândula mamária em camundongos fêmeas tratadas apenas com a dose mais baixa (2,5 mg / kg / dia). Não houve aumento relacionado ao tratamento na neoplasia em ratos.
O potencial carcinogênico do metabólito da iloperidona P95, que é o principal metabólito circulante da iloperidona em humanos, mas não está presente em quantidades significativas em camundongos ou em um estudo de carcinogenicidade ao longo da vida em ratos Wistar em doses orais de 25, 75 e 200 mg / kg / dia em machos e 50, 150 e 250 (reduzido de 400) mg / kg / dia em fêmeas. Alterações neoplásicas relacionadas a medicamentos ocorreram em homens, na hipófise (adenoma pars distalis) em todas as doses e no pâncreas (adenoma de células das ilhotas) em altas doses. Os níveis plasmáticos de P95 (AUC) nos machos nas doses testadas (25, 75 e 200 mg / kg / dia) foram aproximadamente 0,4, 3 e 23 vezes, respectivamente, a exposição humana ao P95 no MRHD da iloperidona.
Mutagênese: A iloperidona foi negativa no teste de Ames e nos testes in vivo de medula óssea de camundongo e micronúcleo de fígado de rato. A iloperidona induziu aberrações cromossômicas em células do Ovário de Hamster Chinês (CHO) in vitro em concentrações que também causaram alguma citotoxicidade.
O metabólito da iloperidona P95 foi negativo no teste de Ames, no teste de aberração cromossômica V79 e no teste in vivo de micronúcleo de medula óssea em camundongos.
Comprometimento da fertilidade: A iloperidona diminuiu a fertilidade em 12 e 36 mg / kg em um estudo no qual ratos machos e fêmeas foram tratados. A dose sem efeito foi de 4 mg / kg, que é 1,6 vezes o MRHD de 24 mg / dia em uma base mg / m2.
topo
Estudos clínicos
A eficácia do FANAPT no tratamento da esquizofrenia foi apoiada por 2 placebo e ensaios de curto prazo controlados por ativos (4- e 6 semanas) e um estudo randomizado, controlado a placebo, a longo prazo julgamento de abstinência. Todos os estudos incluíram pacientes que preenchiam os critérios do DSM-III / IV para esquizofrenia.
Três instrumentos foram utilizados para avaliar sinais e sintomas psiquiátricos nesses estudos. A Escala de Síndrome Positiva e Negativa (PANSS) e a Escala Breve de Classificação Psiquiátrica (BPRS) são inventários de vários itens.
psicopatologia geral geralmente usada para avaliar os efeitos do tratamento medicamentoso na esquizofrenia. A avaliação da Impressão Clínica Global (CGI) reflete a impressão de um observador experiente, totalmente familiarizado com as manifestações da esquizofrenia, sobre o estado clínico geral do paciente.
Um estudo controlado por placebo de 6 semanas (n = 706) envolveu 2 faixas de doses flexíveis de FANAPT (12-16 mg / dia ou 20-24 mg / dia) em comparação ao placebo e um controle ativo (risperidona). Para o grupo de 12 a 16 mg / dia, o esquema de titulação de FANAPT foi de 1 mg duas vezes ao dia nos dias 1 e 2, 2 mg duas vezes ao dia nos dias 3 e 4, 4 mg duas vezes ao dia nos dias 5 e 6 e 6 mg duas vezes diariamente no dia 7. Para o grupo 20-24 mg / dia, o esquema de titulação do FANAPT foi de 1 mg duas vezes ao dia no dia 1, 2 mg duas vezes ao dia no dia 2, 4 mg duas vezes ao dia no dia 3, 6 mg duas vezes ao dia nos dias 4 e 5, 8 mg duas vezes ao dia no dia 6 e 10 mg duas vezes ao dia no dia 7. O endpoint primário foi a mudança da linha de base na pontuação total do BPRS no final do tratamento (dia 42). Os intervalos de dose de 12-16 mg / dia e 20-24 mg / dia de FANAPT foram superiores ao placebo na pontuação total do BPRS. O medicamento antipsicótico de controle ativo pareceu ser superior ao FANAPT neste estudo nos primeiros 2 semanas, uma descoberta que pode em parte ser explicada pela titulação mais rápida possível para aquela droga. Nos pacientes deste estudo que permaneceram em tratamento por pelo menos 2 semanas, a iloperidona parecia ter eficácia comparável ao controle ativo.
Um estudo controlado por placebo de 4 semanas (n = 604) envolveu uma dose fixa de FANAPT (24 mg / dia) em comparação ao placebo e um controle ativo (ziprasidona). O cronograma de titulação para este estudo foi semelhante ao do estudo de 6 semanas. Este estudo envolveu a titulação do FANAPT começando com 1 mg duas vezes ao dia no dia 1 e aumentando para 2, 4, 6, 8, 10 e 12 mg duas vezes ao dia nos dias 2, 3, 4, 5, 6 e 7. O endpoint primário foi a mudança da linha de base na pontuação total do PANSS no final do tratamento (dia 28). A dose de 24 mg / dia de FANAPT foi superior ao placebo no escore total do PANSS. O FANAPT parecia ter eficácia semelhante ao medicamento de controle ativo, que também precisava de uma titulação lenta da dose alvo.
Em um estudo de longo prazo, pacientes ambulatoriais adultos clinicamente estáveis (n = 303) atendem aos critérios do DSM-IV para esquizofrenia que permaneceram estáveis após 12 semanas de tratamento. O tratamento aberto com doses flexíveis de FANAPT (8 mg / dia - 24 mg / dia administrados em doses duas vezes ao dia) foram randomizados para placebo ou para continuar na sua dose atual de FANAPT (8 mg / dia - 24 mg / dia administrada em doses duas vezes ao dia) para observação de possível recaída durante a recaída em dupla ocultação fase de prevenção. A estabilização durante a fase de rótulo aberto foi definida como sendo uma dose estabelecida de FANAPT que permaneceu inalterada devido à eficácia nas 4 semanas anteriores à randomização, com pontuação de CGI-gravidade de ≤4 e pontuação total de PANSS ≤70, uma pontuação de ≤4 em cada um dos seguintes itens individuais de PANSS (delírios de P1, desorganização conceitual de P2, Comportamento alucinatório de P3, suspeita / perseguição de P6, hostilidade de P7 ou falta de cooperação de G8) e ausência de hospitalização ou aumento no nível de atendimento a ser tratado exacerbações. Recaída ou recaída iminente durante a fase de prevenção de recaída em dupla ocultação foi definida como seguinte: hospitalização por piora da esquizofrenia, aumento (piora) da pontuação total do PANSS ≥30%, CGI-
Escore de melhoria ≥ 6, paciente teve comportamento suicida, homicida ou agressivo ou necessidade de qualquer outro medicamento antipsicótico.

Com base na análise interina, um comitê independente de monitoramento de dados decidiu que o estudo deveria ser interrompido precocemente devido a evidências de eficácia. Com base nos resultados da análise interina, confirmados pelo conjunto de dados da análise final, os pacientes tratados com O FANAPT teve um tempo estatisticamente significativo mais longo para recidiva ou recaída iminente do que os pacientes que receberam placebo. A Figura 1 mostra a proporção cumulativa estimada de pacientes com recaída ou recaída iminente com base no conjunto de dados final.
topo
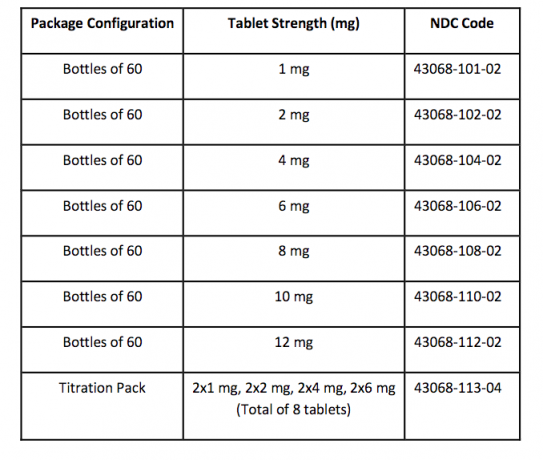
Como Fornecido / Armazenamento e Manuseio
Os comprimidos FANAPT são brancos, redondos e identificados com um logotipo gravado em um lado e força "1", "2", "4", "6", "8", "10" ou "12" no outro lado lado. Os comprimidos são fornecidos nos seguintes pontos fortes e configurações da embalagem:
Armazenamento
Armazene os comprimidos FANAPT em temperatura ambiente controlada, 25 ° C (77 ° F); excursões permitidas a 15 ° a 30 ° C (59 ° a 86 ° F) [Consulte Temperatura controlada da USP]. Proteger os comprimidos FANAPT da exposição à luz e à umidade.
INFORMAÇÃO DE ACONSELHAMENTO DO PACIENTE
Os médicos são aconselhados a discutir os seguintes problemas com pacientes para os quais prescrevem o FANAPT:
Prolongamento do intervalo QT
Os pacientes devem ser aconselhados a consultar seu médico imediatamente se sentirem desmaio, desmaiarem ou tiverem palpitações cardíacas. Os pacientes devem ser aconselhados a não tomar FANAPT com outros medicamentos que causam prolongamento do intervalo QT. Os pacientes devem ser instruídos a informar os médicos de que estão tomando o FANAPT antes que qualquer novo medicamento seja tomado.
Síndrome maligna neuroléptica
Pacientes e cuidadores devem ser informados de que um complexo de sintomas potencialmente fatal às vezes como NMS foi relatado em associação com a administração de medicamentos antipsicóticos, incluindo o FANAPT. Os sinais e sintomas da SMN incluem hiperpirexia, rigidez muscular, estado mental alterado e evidência de autonômica
instabilidade (pulso ou pressão arterial irregular, taquicardia, diaforese e disritmia cardíaca).
Alterações metabólicas
Os pacientes devem estar cientes dos sintomas de hiperglicemia (alto nível de açúcar no sangue) e diabetes mellitus. Pacientes diagnosticados com diabetes, aqueles com fatores de risco para diabetes ou aqueles que desenvolvem esses sintomas durante o tratamento devem ter a glicemia monitorada no início e periodicamente durante tratamento. Os pacientes devem ser informados de que ocorreu ganho de peso durante o tratamento com FANAPT. Recomenda-se o monitoramento clínico do peso.
Hipotensão ortostática
Os pacientes devem ser avisados sobre o risco de hipotensão ortostática, particularmente no momento de iniciar o tratamento, reiniciar o tratamento ou aumentar a dose.
Interferência no desempenho cognitivo e motor
Como o FANAPT pode ter o potencial de prejudicar o julgamento, o pensamento ou as habilidades motoras, os pacientes devem ser alertados sobre operar máquinas perigosas, incluindo automóveis, até que estejam razoavelmente certos de que a terapia com FANAPT não os afeta adversamente.
Gravidez
Informe aos pacientes que o uso do Fanapt no terceiro trimestre pode causar sintomas extrapiramidais e / ou de abstinência em um neonato. Aconselhe as pacientes a notificar seu médico com gravidez conhecida ou suspeita.
Registro de Gravidez
Informe às pacientes que existe um registro de exposição à gravidez que monitora os resultados da gravidez em mulheres expostas ao FANAPT durante a gravidez
Lactação
Aconselhe as mulheres a não amamentarem durante o tratamento com FANAPT.
Medicação concomitante
Os pacientes devem ser aconselhados a informar seus médicos se estiverem tomando ou planejam tomar alguma prescrição ou medicamento sem prescrição médica, pois existe potencial para interações.
Álcool
Os pacientes devem ser aconselhados a evitar o álcool enquanto tomam FANAPT.
Exposição ao calor e desidratação
Os pacientes devem ser avisados sobre os cuidados adequados para evitar superaquecimento e desidratação.
Distribuído por:
Vanda Pharmaceuticals Inc.
Washington, D.C. 20037 EUA
Vanda e Fanapt® são marcas registradas da Vanda Pharmaceuticals Inc. nos Estados Unidos e em outros países.
de volta ao topo
Guia de Prescrição de Fanapt (Iloperidone) (PDF)
As informações nesta monografia não se destinam a cobrir todos os usos possíveis, instruções, precauções, interações medicamentosas ou efeitos adversos. Esta informação é generalizada e não se destina a aconselhamento médico específico. Se você tiver dúvidas sobre os medicamentos que está tomando ou quiser obter mais informações, consulte seu médico, farmacêutico ou enfermeiro.
última atualização em 13/07
de volta a: Página inicial de farmacologia de medicamentos psiquiátricos


