Janumet para tratamento de diabetes
Marca: Janumet
Nome genérico: Sitagliptina e cloridrato de metformina
Conteúdo:
Indicações e uso
Dosagem e Administração
Formas e dosagens de dosagem
Contra-indicações
Avisos e Precauções
Reações adversas
Interações medicamentosas
Uso em populações específicas
Overdose
Descrição
Farmacologia
Toxicologia Não Clínica
Estudos clínicos
Como fornecido
Informações sobre aconselhamento ao paciente
Janumet, Sitagliptina e Cloridrato de Metformina, Informações ao Paciente (Em inglês simples)
AVISO: ACIDOSE LÁTICA
A acidose láctica é uma complicação rara, mas grave, que pode ocorrer devido ao acúmulo de metformina. O risco aumenta com condições como sepse, desidratação, ingestão excessiva de álcool, insuficiência hepática, insuficiência renal e insuficiência cardíaca congestiva aguda.
O início geralmente é sutil, acompanhado apenas por sintomas inespecíficos, como mal-estar, mialgias, dificuldade respiratória, sonolência crescente e dificuldade abdominal inespecífica. Anormalidades laboratoriais incluem pH baixo, aumento do gap aniônico e aumento de lactato sanguíneo.
Se houver suspeita de acidose, Janumet1 deve ser descontinuado e o paciente hospitalizado imediatamente. [Vejo Avisos e Precauções]
Indicações e uso
Janumet é indicado como um complemento da dieta e do exercício para melhorar o controle glicêmico em adultos com diabetes mellitus tipo 2 quando o tratamento com sitagliptina e metformina é apropriado. [Vejo Estudos clínicos.]
Limitações importantes de uso
Janumet não deve ser utilizado em pacientes com diabetes tipo 1 ou no tratamento da cetoacidose diabética, pois não seria eficaz nesses locais.
Janumet não foi estudado em combinação com insulina.
topo
Dosagem e Administração
Dosagem recomendada
A dosagem da terapia anti-hiperglicêmica com Janumet deve ser individualizada com base no regime atual do paciente, eficácia e tolerabilidade, embora não exceda a dose diária máxima recomendada de 100 mg de sitagliptina e 2000 mg metformina. A terapia combinada inicial ou a manutenção da terapia combinada devem ser individualizadas e deixadas ao critério do médico.
O Janumet deve geralmente ser administrado duas vezes ao dia com as refeições, com aumento gradual da dose, para reduzir os efeitos colaterais gastrointestinais (GI) devido à metformina.
A dose inicial de Janumet deve basear-se no regime atual do paciente. Janumet deve ser administrado duas vezes ao dia com as refeições. As seguintes doses estão disponíveis:
50 mg de sitagliptina / 500 mg de cloridrato de metformina
50 mg de sitagliptina / 1000 mg de cloridrato de metformina.
Pacientes inadequadamente controlados apenas com dieta e exercício
Se a terapia com um comprimido combinado contendo sitagliptina e metformina for considerada apropriada para um paciente com diabetes mellitus tipo 2 inadequadamente controlado apenas com dieta e exercício, a dose inicial recomendada é de 50 mg de sitagliptina / 500 mg de cloridrato de metformina duas vezes diariamente. Pacientes com controle glicêmico inadequado com esta dose podem ser titulados até 50 mg de sitagliptina / 1000 mg de cloridrato de metformina duas vezes ao dia.
Pacientes inadequadamente controlados com metformina em monoterapia
Se a terapêutica com um comprimido combinado contendo sitagliptina e metformina for considerada adequada para um doente controlado de forma inadequada apenas com metformina, o A dose inicial recomendada de Janumet deve fornecer sitagliptina na dose de 50 mg duas vezes ao dia (dose diária total de 100 mg) e a dose de metformina já sendo ocupado. Nos doentes a tomar metformina 850 mg duas vezes por dia, a dose inicial recomendada de Janumet é 50 mg de sitagliptina / 1000 mg de cloridrato de metformina duas vezes por dia.
Pacientes inadequadamente controlados com sitagliptina em monoterapia
Se a terapêutica com um comprimido combinado contendo sitagliptina e metformina for considerada adequada para um doente de forma inadequada controlado apenas com sitagliptina, a dose inicial recomendada de Janumet é de 50 mg de sitagliptina / 500 mg de cloridrato de metformina duas vezes diariamente. Os pacientes com controle inadequado dessa dose podem ser titulados em até 50 mg de sitagliptina / 1000 mg de cloridrato de metformina duas vezes ao dia. Os doentes tratados com sitagliptina em monoterapia, ajustados à dose para insuficiência renal, não devem mudar para Janumet [ver Contra-indicações].
Pacientes que mudam da coadministração de sitagliptina e metformina
Nos doentes que mudam de sitagliptina administrada concomitantemente com metformina, Janumet pode ser iniciado com a dose de sitagliptina e metformina já em uso.
Pacientes controlados inadequadamente em terapia de combinação dupla com dois dos seguintes agentes anti-hiperglicêmicos: sitagliptina, metformina ou sulfonilureia
Se a terapêutica com um comprimido combinado contendo sitagliptina e metformina for considerada adequada neste A dose inicial habitual de Janumet deve fornecer sitagliptina na dose de 50 mg duas vezes ao dia (100 mg no total dose diária). Ao determinar a dose inicial do componente metformina, o nível de controle glicêmico do paciente e a dose atual (se houver) de metformina devem ser considerados. A escalada gradual da dose para reduzir os efeitos colaterais gastrointestinais (GI) associados à metformina deve ser considerada. Os pacientes atualmente em uso ou iniciando uma sulfonilureia podem precisar de doses mais baixas de sulfonilureia para reduzir o risco de hipoglicemia [ver Avisos e Precauções].
Não foram realizados estudos que examinem especificamente a segurança e eficácia de Janumet em pacientes tratados anteriormente com outros agentes anti-hiperglicêmicos orais e mudaram para Janumet. Qualquer mudança na terapia do diabetes tipo 2 deve ser realizada com cuidado e monitoramento apropriado, pois podem ocorrer alterações no controle glicêmico.
topo
Formas e dosagens de dosagem
- Os comprimidos de 50 mg / 500 mg são comprimidos revestidos por película cor de rosa claro, em forma de cápsula, com a gravação "575" numa das faces.
- Os comprimidos de 50 mg / 1000 mg são comprimidos revestidos por película, vermelhos, em forma de cápsula, com a gravação "577" numa das faces.
topo
Contra-indicações
Janumet (sitagliptina / metformina HCl) está contra-indicado em doentes com:
- Doença renal ou disfunção renal, por exemplo, conforme sugerido pelos níveis séricos de creatinina> 1,5 mg / dL [homens],> 1,4 mg / dL [mulheres] ou anormal depuração da creatinina que também pode resultar de condições como colapso cardiovascular (choque), infarto agudo do miocárdio e septicemia [Vejo Avisos e Precauções].
- Acidose metabólica aguda ou crônica, incluindo cetoacidose diabética, com ou sem coma.
- História de uma reação grave de hipersensibilidade ao Janumet ou à sitagliptina (um dos componentes do Janumet), como anafilaxia ou angioedema. [Vejo Avisos e Precauções e Reações adversas.]
Janumet deve ser descontinuado temporariamente em pacientes submetidos a estudos radiológicos envolvendo procedimentos intravasculares. administração de materiais de contraste iodados, porque o uso de tais produtos pode resultar em alteração aguda da função [ver Avisos e Precauções].
topo
Avisos e Precauções
Acidose láctica
Cloridrato de metformina
A acidose láctica é uma complicação metabólica rara, mas grave, que pode ocorrer devido ao acúmulo de metformina durante o tratamento com Janumet; quando ocorre, é fatal em aproximadamente 50% dos casos. A acidose láctica também pode ocorrer em associação com várias condições fisiopatológicas, incluindo diabetes mellitus, e sempre que houver hipoperfusão tecidual e hipoxemia significativas. A acidose láctica é caracterizada por níveis elevados de lactato sanguíneo (> 5 mmol / L), diminuição do pH sanguíneo, distúrbios eletrolíticos com aumento do hiato aniônico e aumento da razão lactato / piruvato. Quando a metformina está implicada como causa da acidose láctica, geralmente são encontrados níveis plasmáticos de metformina> 5 ng / mL.
A incidência relatada de acidose láctica em pacientes que recebem cloridrato de metformina é muito baixa (aproximadamente 0,03 casos / 1.000 pacientes-ano, com aproximadamente 0,015 casos fatais / 1000 anos-paciente). Em mais de 20.000 pacientes / ano de exposição à metformina em ensaios clínicos, não houve relatos de acidose láctica. Os casos relatados ocorreram principalmente em pacientes diabéticos com insuficiência renal significativa, incluindo ambos os casos doença e hipoperfusão renal, muitas vezes no cenário de múltiplos problemas médicos / cirúrgicos concomitantes e múltiplos concomitantes medicações. Pacientes com insuficiência cardíaca congestiva que necessitam de tratamento farmacológico, em particular aqueles com instabilidade ou insuficiência cardíaca congestiva aguda com risco de hipoperfusão e hipoxemia, apresentam risco aumentado de acidose. O risco de acidose láctica aumenta com o grau de disfunção renal e com a idade do paciente. O risco de acidose láctica pode, portanto, ser significativamente diminuído pelo monitoramento regular da função renal em pacientes que tomam metformina e pelo uso da dose efetiva mínima de metformina. Em particular, o tratamento dos idosos deve ser acompanhado de um cuidadoso monitoramento da função renal. O tratamento com metformina não deve ser iniciado em pacientes com idade> 80 anos, a menos que a medição da depuração da creatinina demonstra que a função renal não é reduzida, pois esses pacientes são mais suscetíveis ao desenvolvimento de acidose láctica. Além disso, a metformina deve ser prontamente suspensa na presença de qualquer condição associada à hipoxemia, desidratação ou sepse. Como a função hepática comprometida pode limitar significativamente a capacidade de eliminar o lactato, a metformina geralmente deve ser evitada em pacientes com evidências clínicas ou laboratoriais de doença hepática. Os pacientes devem ser advertidos contra a ingestão excessiva de álcool, aguda ou crônica, ao tomar metformina, uma vez que o álcool potencializa os efeitos do cloridrato de metformina no metabolismo do lactato. Além disso, a metformina deve ser temporariamente descontinuada antes de qualquer estudo por radiocontraste intravascular e para qualquer procedimento cirúrgico [ver Avisos e Precauções].
O início da acidose láctica geralmente é sutil e acompanhado apenas por sintomas inespecíficos, como mal-estar, mialgias, dificuldade respiratória, sonolência crescente e dificuldade abdominal inespecífica. Pode haver hipotermia, hipotensão e bradiarritmias resistentes associadas a acidose mais acentuada. O paciente e o médico do paciente devem estar cientes da possível importância de tais sintomas e devem ser instruídos a notificar o médico imediatamente se ocorrerem [consulte Avisos e Precauções]. A metformina deve ser retirada até que a situação seja esclarecida. Eletrólitos séricos, cetonas, glicose no sangue e, se indicado, pH no sangue, níveis de lactato e até níveis de metformina no sangue podem ser úteis. Uma vez estabilizado o paciente em qualquer nível de dose de metformina, é improvável que os sintomas gastrointestinais, comuns durante o início da terapia, estejam relacionados ao medicamento. A ocorrência posterior de sintomas gastrointestinais pode ser causada por acidose láctica ou outra doença grave.
Níveis de lactato plasmático venoso em jejum acima do limite superior do normal, mas inferior a 5 mmol / L em pacientes que tomam metformina, não indicam necessariamente problemas lácticos iminentes. acidose e pode ser explicada por outros mecanismos, como diabetes ou obesidade mal controlada, atividade física vigorosa ou problemas técnicos no manuseio de amostras [Vejo Avisos e Precauções].
Deve-se suspeitar de acidose láctica em qualquer paciente diabético com acidose metabólica sem evidências de cetoacidose (cetonúria e cetonemia).
A acidose láctica é uma emergência médica que deve ser tratada em ambiente hospitalar. Em um paciente com acidose láctica em uso de metformina, o medicamento deve ser descontinuado imediatamente e medidas de suporte gerais prontamente instituídas. Como o cloridrato de metformina é dialisável (com uma depuração de até 170 mL / min sob boas condições hemodinâmicas). condições), recomenda-se hemodiálise imediata para corrigir a acidose e remover o acúmulo metformina. Esse gerenciamento geralmente resulta em reversão imediata dos sintomas e recuperação [ver Contra-indicações; Avisos e Precauções].
Função hepática prejudicada
Uma vez que a função hepática comprometida foi associada a alguns casos de acidose láctica, Janumet deve geralmente ser evitado em pacientes com evidências clínicas ou laboratoriais de doença hepática.
Avaliação da função renal
Sabe-se que a metformina e a sitagliptina são substancialmente excretadas pelo rim. O risco de acúmulo de metformina e acidose láctica aumenta com o grau de comprometimento da função renal. Assim, pacientes com níveis séricos de creatinina acima do limite superior do normal para a idade não devem receber Janumet. Nos idosos, Janumet deve ser cuidadosamente titulado para estabelecer a dose mínima para um efeito glicêmico adequado, porque o envelhecimento pode estar associado à redução da função renal. [Vejo Avisos e Precauções e Uso em populações específicas.]
Antes do início do tratamento com Janumet e, pelo menos anualmente, posteriormente, a função renal deve ser avaliada e verificada normalmente. Nos pacientes em que se antecipa o desenvolvimento de disfunção renal, particularmente em pacientes idosos, a função deve ser avaliada com mais frequência e Janumet descontinuado se houver evidência de insuficiência renal presente.
Vitamina B12 Níveis
Em ensaios clínicos controlados de metformina com 29 semanas de duração, uma diminuição para níveis subnormais de vitamina B sérica anteriormente normal12 níveis, sem manifestações clínicas, foram observados em aproximadamente 7% dos pacientes. Essa diminuição, possivelmente devido à interferência com B12 absorção do B12fator complexo intrínseco, no entanto, é muito raramente associado à anemia e parece ser rapidamente reversível com a descontinuação da metformina ou da vitamina B12 suplementação. A medição dos parâmetros hematológicos anualmente é recomendada em pacientes em Janumet e quaisquer anormalidades aparentes devem ser investigadas e gerenciadas adequadamente. [Vejo Reações adversas.]
Certos indivíduos (aqueles com vitamina B inadequada12 ou ingestão ou absorção de cálcio) parecem predispor ao desenvolvimento de vitamina B subnormal12 níveis. Nesses pacientes, a vitamina B sérica de rotina12 medições em intervalos de dois a três anos podem ser úteis.
Ingestão de Álcool
Sabe-se que o álcool potencializa o efeito da metformina no metabolismo do lactato. Portanto, os pacientes devem ser alertados contra a ingestão excessiva de álcool, aguda ou crônica, enquanto estiver recebendo Janumet.
Procedimentos cirúrgicos
O uso de Janumet deve ser temporariamente suspenso para qualquer procedimento cirúrgico (exceto procedimentos menores não associados à ingestão restrita alimentos e líquidos) e não deve ser reiniciado até que a ingestão oral do paciente seja retomada e a função renal tenha sido avaliada como normal.
Alteração do estado clínico de pacientes com diabetes tipo 2 previamente controlado
Um paciente com diabetes tipo 2 previamente bem controlado com Janumet que desenvolve anormalidades laboratoriais ou clínicas doença (especialmente doença vaga e mal definida) deve ser avaliada prontamente quanto a evidências de cetoacidose ou acidose. A avaliação deve incluir eletrólitos e cetonas séricos, glicemia e, se indicado, níveis de pH, lactato, piruvato e metformina no sangue. Se ocorrer acidose de qualquer das formas, o Janumet deve ser interrompido imediatamente e iniciadas outras medidas corretivas.
Use com medicamentos conhecidos por causar hipoglicemia
Sitagliptina
Como é típico em outros agentes anti-hiperglicêmicos usados em combinação com uma sulfonilureia, quando a sitagliptina foi usada em combinação com a metformina e uma sulfonilureia, um medicamento conhecido por causar hipoglicemia, a incidência de hipoglicemia foi aumentada em relação à do placebo em combinação com metformina e sulfonilureia [ver Reações adversas]. Portanto, os pacientes que também recebem um secretagogo de insulina (por exemplo, sulfonilureia, meglitinida) podem exigir uma dose mais baixa do secretagogo de insulina para reduzir o risco de hipoglicemia [ver Dosagem e Administração].
Cloridrato de metformina
A hipoglicemia não ocorre em pacientes que recebem metformina isoladamente em circunstâncias usuais de uso, mas pode ocorrer quando a ingestão calórica é deficiente, quando o exercício extenuante não é compensado pela suplementação calórica ou durante o uso concomitante com outros agentes redutores de glicose (como sulfonilureias e insulina) ou etanol. Pacientes idosos, debilitados ou desnutridos e aqueles com insuficiência adrenal ou hipofisária ou intoxicação alcoólica são particularmente suscetíveis a efeitos hipoglicêmicos. Pode ser difícil reconhecer a hipoglicemia em idosos e em pessoas que estão tomando medicamentos bloqueadores p-adrenérgicos.
Medicamentos concomitantes que afetam a função renal ou a disposição da metformina
Medicamentos concomitantes que podem afetar a função renal ou resultar em alteração hemodinâmica significativa ou podem interferir na disposição da metformina, como drogas catiônicas que são eliminadas pela secreção tubular renal [Vejo Interações medicamentosas], deve ser usado com cuidado.
Estudos radiológicos com materiais de contraste iodados intravasculares
Estudos de contraste intravascular com materiais iodados (por exemplo, urograma intravenoso, colangiografia intravenosa, angiografia e tomografia computadorizada (TC)) com materiais de contraste intravasculares) pode levar a alteração aguda da função renal e ter sido associada a acidose láctica em pacientes que recebem metformina [ver Contra-indicações]. Portanto, nos pacientes nos quais esse estudo está planejado, Janumet deve ser temporariamente descontinuado no momento ou antes da e retido por 48 horas após o procedimento e reinstituído somente após a função renal ter sido reavaliada e encontrada Seja normal.
Estados hipóxicos
Colapso cardiovascular (choque) por qualquer causa, insuficiência cardíaca congestiva aguda, infarto agudo do miocárdio e outras condições caracterizadas por hipoxemia foram associadas à acidose láctica e também podem causar lesões pré-renais. azotemia. Quando tais eventos ocorrem em pacientes em tratamento com Janumet, o medicamento deve ser imediatamente descontinuado.
Perda de controle da glicose no sangue
Quando um paciente estabilizado em qualquer regime diabético é exposto ao estresse, como febre, trauma, infecção ou cirurgia, pode ocorrer uma perda temporária do controle glicêmico. Nesses momentos, pode ser necessário suspender o Janumet e administrar temporariamente a insulina. Janumet pode ser reinstituído após a resolução do episódio agudo.
Reações de hipersensibilidade
Houve relatos pós-comercialização de reações graves de hipersensibilidade em pacientes tratados com sitagliptina, um dos componentes do Janumet. Essas reações incluem anafilaxia, angioedema e doenças esfoliativas da pele, incluindo a síndrome de Stevens-Johnson. Como essas reações são relatadas voluntariamente em uma população de tamanho incerto, geralmente é não é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento. O início dessas reações ocorreu nos primeiros 3 meses após o início do tratamento com sitagliptina, com alguns relatos ocorrendo após a primeira dose. Se houver suspeita de uma reação de hipersensibilidade, interrompa o Janumet, avalie outras causas potenciais para o evento e institua um tratamento alternativo para o diabetes. [Vejo Reações adversas.]
Resultados Macrovasculares
Não houve estudos clínicos que estabelecessem evidências conclusivas de redução de risco macrovascular com Janumet ou qualquer outro medicamento antidiabético.
topo
Reações adversas
Experiência em ensaios clínicos
Como os ensaios clínicos são conduzidos sob condições amplamente variadas, as taxas de reação adversa observadas nos ensaios clínicos de um medicamento não pode ser diretamente comparado com as taxas nos ensaios clínicos de outra droga e pode não refletir as taxas observadas em prática.
Co-administração de sitagliptina e metformina em pacientes com diabetes tipo 2 inadequadamente controlados por dieta e exercício
A Tabela 1 resume as reações adversas mais comuns (≥ 5% dos pacientes) relatadas (independentemente da avaliação da causalidade pelo investigador) em 24 semanas estudo fatorial controlado por placebo, no qual sitagliptina e metformina foram co-administradas a pacientes com diabetes tipo 2 inadequadamente controlados na dieta e exercício.
Tabela 1: Sitagliptina e metformina co-administradas em pacientes com diabetes tipo 2 inadequadamente controlados por dieta e exercício: reações adversas Relatado (independentemente da avaliação da causalidade pelo investigador) em ¥ 5% dos pacientes que recebem terapia combinada (e maior que nos pacientes que recebem Placebo)*
| Número de pacientes (%) | ||||
Placebo |
Sitagliptina 100 mg QD |
Metformina 500 mg / Metformina 1000 mg, bid†|
Sitagliptina Oferta de 50 mg + Metformina 500 mg / Metformina 1000 mg, bid†|
|
| N = 176 | N = 179 | N = 364†| N = 372†| |
| ||||
| Diarréia | 7 (4.0) | 5 (2.8) | 28 (7.7) | 28 (7.5) |
| Infecção do trato respiratório superior | 9 (5.1) | 8 (4.5) | 19 (5.2) | 23 (6.2) |
| Dor de cabeça | 5 (2.8) | 2 (1.1) | 14 (3.8) | 22 (5.9) |
Terapia adicional com sitagliptina em pacientes com diabetes tipo 2 inadequadamente controlada com metformina sozinha
Num ensaio de 24 semanas controlado com placebo de sitagliptina 100 mg, administrado uma vez ao dia, adicionado a um regime de metformina duas vezes ao dia, não houve reações adversas relatadas, independentemente da avaliação do investigador sobre a causalidade em <5% dos pacientes e mais comumente do que nos pacientes placebo. A descontinuação do tratamento devido a reações adversas clínicas foi semelhante ao grupo de tratamento com placebo (sitagliptina e metformina, 1,9%; placebo e metformina, 2,5%).
Hipoglicemia
As reações adversas da hipoglicemia foram baseadas em todos os relatos de hipoglicemia; não foi necessária uma medição simultânea da glicose. A incidência geral de reações adversas pré-especificadas de hipoglicemia em pacientes com diabetes tipo 2 inadequadamente controlados com dieta e exercício foi de 0,6% em pacientes que receberam placebo, 0,6% em pacientes que receberam apenas sitagliptina, 0,8% em pacientes que receberam apenas metformina e 1,6% em pacientes que receberam sitagliptina em combinação com metformina. Em pacientes com diabetes tipo 2 inadequadamente controlados apenas com metformina, a incidência geral de efeitos adversos as reações de hipoglicemia foram de 1,3% nos pacientes que receberam sitagliptina adicional e de 2,1% nos pacientes que receberam complemento placebo.
Reações adversas gastrointestinais
As incidências de experiências adversas gastrointestinais pré-selecionadas em pacientes tratados com sitagliptina e metformina foram semelhantes às relatadas para pacientes tratados apenas com metformina. Veja a tabela 2.
Tabela 2: Reações adversas gastrointestinais pré-selecionadas (independentemente da avaliação da causalidade pelo investigador) relatadas em pacientes com diabetes tipo 2 que receberam sitagliptina e metformina.
| Número de pacientes (%) | ||||||
| Estudo de Sitagliptina e Metformina em Pacientes Controlados Inadequadamente sobre dieta e exercício |
Estudo do complemento de sitagliptina em pacientes inadequadamente controlados apenas com metformina | |||||
Placebo |
Sitagliptina 100 mg QD |
Metformina 500 mg / Metformina 1000 mg, bid* |
Sitagliptina Oferta de 50 mg + Metformina 500 mg / Metformina 1000 mg, bid* |
Placebo e Metformina ¥ 1500 mg por dia |
Sitagliptina 100 mg, QD e metformina ¥ 1500 mg por dia |
|
| N = 176 | N = 179 | N = 364 | N = 372 | N = 237 | N = 464 | |
| ||||||
| Diarréia | 7 (4.0) | 5 (2.8) | 28 (7.7) | 28 (7.5) | 6 (2.5) | 11 (2.4) |
| Náusea | 2 (1.1) | 2 (1.1) | 20 (5.5) | 18 (4.8) | 2 (0.8) | 6 (1.3) |
| Vômito | 1 (0.6) | 0 (0.0) | 2 (0.5) | 8 (2.2) | 2 (0.8) | 5 (1.1) |
| Dor abdominal†| 4 (2.3) | 6 (3.4) | 14 (3.8) | 11 (3.0) | 9 (3.8) | 10 (2.2) |
Sitagliptina em combinação com metformina e glimepirida
Em um estudo de 24 semanas controlado com placebo de sitagliptina 100 mg como terapia complementar em pacientes com diabetes tipo 2 inadequadamente controlado com metformina e glimepirida (sitagliptina, N = 116; placebo, N = 113), as reações adversas relatadas, independentemente da avaliação do investigador sobre a causalidade em <5% dos pacientes tratados com sitagliptina e mais comumente do que em pacientes tratados com placebo foram: hipoglicemia (sitagliptina, 16,4%; placebo, 0,9%) e dor de cabeça (6,9%, 2,7%).
Não foram observadas alterações clinicamente significativas nos sinais vitais ou no ECG (incluindo no intervalo QTc) com a combinação de sitagliptina e metformina.
A experiência adversa mais comum em monoterapia com sitagliptina relatada, independentemente do investigador avaliação da causalidade em <5% dos pacientes e mais comumente do que nos pacientes que receberam placebo nasofaringite.
As reações adversas estabelecidas mais comuns (> 5%) causadas pelo início da terapia com metformina são diarréia, náusea / vômito, flatulência, desconforto abdominal, indigestão, astenia e dor de cabeça.
Testes laboratoriais
Sitagliptina
A incidência de reações adversas laboratoriais foi semelhante nos pacientes tratados com sitagliptina e metformina (7,6%) em comparação aos pacientes tratados com placebo e metformina (8,7%). Na maioria dos estudos, mas não em todos, um pequeno aumento na contagem de glóbulos brancos (diferença de aproximadamente 200 células / microL nos leucócitos versus placebo; média inicial de leucócitos aproximadamente 6600 células / microL) foi observada devido a um pequeno aumento de neutrófilos. Essa alteração nos parâmetros laboratoriais não é considerada clinicamente relevante.
Cloridrato de metformina
Em ensaios clínicos controlados de metformina com 29 semanas de duração, uma diminuição para níveis subnormais de vitamina B sérica anteriormente normal12 níveis, sem manifestações clínicas, foram observados em aproximadamente 7% dos pacientes. Essa diminuição, possivelmente devido à interferência com B12 absorção do B12fator complexo intrínseco, no entanto, é muito raramente associado à anemia e parece ser rapidamente reversível com a descontinuação da metformina ou da vitamina B12 suplementação. [Vejo Avisos e Precauções.]
Experiência pós-comercialização
As seguintes reações adversas adicionais foram identificadas durante o uso pós-aprovação de Janumet ou sitagliptina, um dos componentes de Janumet. Como essas reações são relatadas voluntariamente em uma população de tamanho incerto, geralmente é não é possível estimar com segurança sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
As reações de hipersensibilidade incluem anafilaxia, angioedema, erupção cutânea, urticária, vasculite cutânea e doenças esfoliativas da pele, incluindo a síndrome de Stevens-Johnson [ver Avisos e Precauções]; infecção do trato respiratório superior; elevações de enzimas hepáticas; pancreatite.
topo
Interações medicamentosas
Drogas catiônicas
Drogas catiônicas (por exemplo, amilorida, digoxina, morfina, procainamida, quinidina, quinina, ranitidina, triamtereno, trimetoprim ou vancomicina) que são eliminados pela secreção tubular renal teoricamente têm o potencial de interação com a metformina, competindo pelo transporte tubular renal comum sistemas. Essa interação entre a metformina e a cimetidina oral foi observada em voluntários saudáveis normais em doses únicas e múltiplas de metformina-cimetidina estudos de interação medicamentosa, com um aumento de 60% no pico de concentração de metformina no plasma e no sangue total e um aumento de 40% no plasma e no metformina no sangue total AUC. Não houve alteração na meia-vida de eliminação no estudo de dose única. A metformina não teve efeito na farmacocinética da cimetidina. Embora essas interações permaneçam teóricas (exceto a cimetidina), o monitoramento cuidadoso do paciente e o ajuste da dose de Janumet e / ou do medicamento interferente é recomendado em pacientes que tomam medicamentos catiônicos que são excretados por via secretora tubular renal proximal sistema.
Digoxina
Houve um ligeiro aumento na área sob a curva (AUC, 11%) e o pico médio da concentração da droga (Cmax, 18%) de digoxina com a co-administração de 100 mg de sitagliptina por 10 dias. Esses aumentos não são considerados prováveis de serem clinicamente significativos. A digoxina, como droga catiônica, tem o potencial de competir com a metformina pelos sistemas de transporte tubular renal comuns, afetando as concentrações séricas de digoxina, metformina ou ambas. Os pacientes que recebem digoxina devem ser monitorados adequadamente. Não é recomendado qualquer ajuste posológico da digoxina ou Janumet.
Gliburida
Num estudo de interação de dose única em pacientes com diabetes tipo 2, a administração concomitante de metformina e gliburida não resultou em alterações na farmacocinética ou na farmacodinâmica da metformina. Diminui a AUC e C da gliburidamax foram observados, mas eram altamente variáveis. A natureza de dose única deste estudo e a falta de correlação entre os níveis sanguíneos de gliburida e os efeitos farmacodinâmicos tornam incerta a importância clínica dessa interação.
Furosemida
Um estudo de interação medicamentosa de metformina-furosemida em dose única em indivíduos saudáveis demonstrou que os parâmetros farmacocinéticos de ambos os compostos foram afetados pela co-administração. A furosemida aumentou as concentrações plasmáticas de metformina e C no sanguemax em 22% e AUC no sangue em 15%, sem qualquer alteração significativa na depuração renal da metformina. Quando administrado com metformina, o Cmax e AUC da furosemida foram 31% e 12% menores, respectivamente, do que quando administrados isoladamente, e a meia-vida terminal diminuiu 32%, sem qualquer alteração significativa na furosemida renal liberação. Nenhuma informação está disponível sobre a interação de metformina e furosemida quando co-administrado cronicamente.
Nifedipina
Um estudo de interação de dose única de metformina-nifedipina em voluntários saudáveis normais demonstrou que a coadministração de nifedipina aumentou a metformina C plasmáticamax e AUC em 20% e 9%, respectivamente, e aumentaram a quantidade excretada na urina. Tmax e a meia-vida não foi afetada. A nifedipina parece aumentar a absorção da metformina. A metformina teve efeitos mínimos na nifedipina.
O uso de metformina com outros medicamentos
Certos medicamentos tendem a produzir hiperglicemia e podem levar à perda do controle glicêmico. Esses medicamentos incluem tiazidas e outros diuréticos, corticosteróides, fenotiazinas, produtos da tireóide, estrogênios, contraceptivos orais, fenitoína, ácido nicotínico, simpatomiméticos, medicamentos bloqueadores dos canais de cálcio e isoniazida. Quando esses medicamentos são administrados a um paciente que recebe Janumet, o paciente deve ser observado com atenção para manter um controle glicêmico adequado.
Em voluntários saudáveis, a farmacocinética da metformina e propranolol e metformina e ibuprofeno não foram afetadas quando co-administradas em estudos de interação com dose única.
A metformina está desprezivelmente ligada às proteínas plasmáticas e, portanto, é menos provável que interaja com drogas altamente ligadas à proteína, como salicilatos, sulfonamidas, cloranfenicol e probenecida, em comparação com as sulfonilureias, que estão extensamente ligadas ao soro proteínas.
topo
Uso em populações específicas
Gravidez
Gravidez Categoria B:
Janumet
Não há estudos adequados e bem controlados em mulheres grávidas com Janumet ou seus componentes individuais; portanto, a segurança de Janumet em mulheres grávidas não é conhecida. Janumet deve ser utilizado durante a gravidez apenas se for claramente necessário.
Merck & Co., Inc. Empresas mantém um registro para monitorar os resultados da gravidez de mulheres expostas ao Janumet durante a gravidez. Os profissionais de saúde são incentivados a relatar qualquer exposição pré-natal a Janumet ligando para o Registro de Gravidez em (800) 986-8999.
Não foram realizados estudos em animais com os produtos combinados em Janumet para avaliar os efeitos na reprodução. Os seguintes dados são baseados em resultados de estudos realizados com sitagliptina ou metformina individualmente.
Sitagliptina
Estudos de reprodução foram realizados em ratos e coelhos. Doses de sitagliptina até 125 mg / kg (aproximadamente 12 vezes a exposição humana na dose máxima humana recomendada) não prejudicaram a fertilidade nem prejudicaram o feto. Contudo, não existem estudos adequados e bem controlados com sitagliptina em mulheres grávidas.
A sitagliptina administrada a ratas e coelhos grávidas do dia 6 a 20 da gestação (organogênese) não era teratogênica em doses orais até 250 mg / kg (ratos) e 125 mg / kg (coelhos), ou aproximadamente 30 e 20 vezes a exposição humana na dose humana máxima recomendada (MRHD) de 100 mg / dia com base na AUC comparações. Doses mais altas aumentaram a incidência de malformações das costelas na prole em 1000 mg / kg, ou aproximadamente 100 vezes a exposição humana no MRHD.
A sitagliptina administrada a ratos fêmeas desde o dia 6 da gestação até o dia 21 da lactação diminuiu o peso corporal na prole masculina e feminina em 1000 mg / kg. Não foi observada toxicidade funcional ou comportamental na prole de ratos.
A transferência placentária de sitagliptina administrada a ratos prenhes foi de aproximadamente 45% em 2 horas e 80% em 24 horas após a dose. A transferência placentária de sitagliptina administrada a coelhos prenhes foi de aproximadamente 66% em 2 horas e 30% em 24 horas.
Cloridrato de metformina
A metformina não foi teratogênica em ratos e coelhos em doses de até 600 mg / kg / dia. Isso representa uma exposição de cerca de 2 e 6 vezes a dose diária máxima recomendada em humanos de 2.000 mg, com base nas comparações da área da superfície corporal de ratos e coelhos, respectivamente. A determinação das concentrações fetais demonstrou uma barreira placentária parcial à metformina.
Mães que amamentam
Não foram realizados estudos em animais lactantes com os componentes combinados de Janumet. Nos estudos realizados com os componentes individuais, a sitagliptina e a metformina são secretadas no leite de ratos lactantes. Não se sabe se a sitagliptina é excretada no leite humano. Como muitos medicamentos são excretados no leite humano, deve-se ter cuidado quando Janumet é administrado a uma mulher que amamenta.
Uso pediátrico
A segurança e eficácia de Janumet em doentes pediátricos com menos de 18 anos não foram estabelecidas.
Uso Geriátrico
Janumet
Como a sitagliptina e a metformina são substancialmente excretadas pelos rins, e como o envelhecimento pode estar associado à redução da função renal, Janumet deve ser usado com cautela à medida que a idade aumenta. Deve-se tomar cuidado na seleção da dose e deve se basear no monitoramento cuidadoso e regular da função renal. [Vejo Avisos e Precauções; Farmacologia Clínica.]
Sitagliptina
Do número total de indivíduos (N = 3884) nos estudos clínicos de Fase II e III de sitagliptina, 725 pacientes tinham 65 anos ou mais, enquanto 61 pacientes tinham 75 anos ou mais. Não foram observadas diferenças gerais em segurança ou eficácia entre os indivíduos com 65 anos ou mais e os mais jovens. Embora essa e outras experiências clínicas relatadas não tenham identificado diferenças nas respostas entre idosos e pacientes mais jovens, uma maior sensibilidade de alguns idosos não pode ser descartado.
Cloridrato de metformina
Os estudos clínicos controlados de metformina não incluíram número suficiente de pacientes idosos para determinar se eles respondem de maneira diferente de pacientes mais jovens, embora outra experiência clínica relatada não tenha identificado diferenças nas respostas entre idosos e jovens pacientes. A metformina deve ser usada apenas em pacientes com função renal normal. A dosagem inicial e de manutenção da metformina deve ser conservadora em pacientes com idade avançada, devido ao potencial de diminuição da função renal nessa população. Qualquer ajuste de dose deve ser baseado em uma avaliação cuidadosa da função renal. [Vejo Contra-indicações; Avisos e Precauções; e Farmacologia Clínica.]
topo
Overdose
Sitagliptina
Durante ensaios clínicos controlados em indivíduos saudáveis, foram administradas doses únicas de até 800 mg de sitagliptina. Aumentos médios máximos no QTc de 8,0 ms foram observados em um estudo com uma dose de 800 mg de sitagliptina, um efeito médio que não é considerado clinicamente importante [ver Farmacologia Clínica]. Não existe experiência com doses acima de 800 mg em seres humanos. Nos estudos de fase múltipla de fase I, não foram observadas reações adversas clínicas relacionadas à dose com sitagliptina com doses de até 400 mg por dia, por períodos de até 28 dias.
No caso de uma overdose, é razoável empregar as medidas de suporte habituais, por exemplo, remover o material não absorvido do trato gastrointestinal. trato, empregar monitoramento clínico (incluindo a obtenção de um eletrocardiograma) e instituir terapia de suporte, conforme indicado pela clínica do paciente. status.
A sitagliptina é modestamente dialisável. Em estudos clínicos, aproximadamente 13,5% da dose foi removida durante uma sessão de hemodiálise de 3 a 4 horas. A hemodiálise prolongada pode ser considerada se clinicamente apropriado. Não se sabe se a sitagliptina é dialisável por diálise peritoneal.
Cloridrato de metformina
Ocorreu sobredosagem de cloridrato de metformina, incluindo ingestão de quantidades superiores a 50 gramas. Hipoglicemia foi relatada em aproximadamente 10% dos casos, mas nenhuma associação causal com cloridrato de metformina foi estabelecida. Foi relatada acidose láctica em aproximadamente 32% dos casos de overdose de metformina [ver Avisos e Precauções]. A metformina é dialisável com uma depuração de até 170 mL / min em boas condições hemodinâmicas. Portanto, a hemodiálise pode ser útil para remover a droga acumulada de pacientes nos quais há suspeita de sobredosagem com metformina.
topo
Descrição
Os comprimidos de Janumet (sitagliptina / metformina HCl) contêm dois medicamentos anti-hiperglicêmicos orais usados no tratamento da diabetes tipo 2: sitagliptina e cloridrato de metformina.
Sitagliptina
A sitagliptina é um inibidor ativo da via oral da enzima dipeptidil peptidase-4 (DPP-4). A sitagliptina está presente nos comprimidos de Janumet na forma de fosfato de sitagliptina monohidratada. O fosfato de sitagliptina monohidratado é descrito quimicamente como 7 - [(3R) - 3 - amino - 1 - oxo - 4 - (2,4,5 - trifluorofenil) butil] - 5,6,7,8 - tetra-hidro-3 - (trifluorometil) - 1,2,4 - triazolo [4,3-a] pirazina fosfato (1: 1) monohidratado com uma fórmula empírica claro16H15F6N5O-H3PO4-H2O e um peso molecular de 523,32. A fórmula estrutural é:
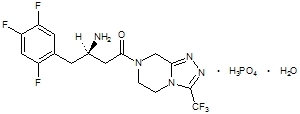
O fosfato de sitagliptina monohidratado é um pó branco a esbranquiçado, cristalino e não higroscópico. É solúvel em água e em N, N-dimetil formamida; ligeiramente solúvel em metanol; muito levemente solúvel em etanol, acetona e acetonitrila; e insolúvel em isopropanol e acetato de isopropil.
Cloridrato de metformina
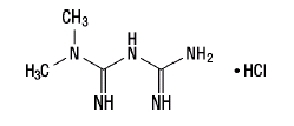
O cloridrato de metformina (cloridrato de diamida N, N-dimetilimidodicarbonimídico) não está quimicamente ou farmacologicamente relacionado a nenhuma outra classe de agentes anti-hiperglicêmicos orais. O cloridrato de metformina é um composto cristalino branco a esbranquiçado com uma fórmula molecular de C4H11N5-HCl e um peso molecular de 165,63. O cloridrato de metformina é livremente solúvel em água e é praticamente insolúvel em acetona, éter e clorofórmio. O pKuma de metformina é 12,4. O pH de uma solução aquosa a 1% de cloridrato de metformina é 6,68. A fórmula estrutural é como mostrado:
Janumet
Janumet está disponível para administração oral como comprimidos contendo 64,25 mg de fosfato de sitagliptina monohidratada e cloridrato de metformina equivalente para: 50 mg de sitagliptina como base livre e 500 mg de cloridrato de metformina (Janumet 50 mg / 500 mg) ou 1000 mg de cloridrato de metformina (Janumet 50 mg / 1000 mg). Cada comprimido revestido por película de Janumet contém os seguintes ingredientes inativos: celulose microcristalina, polivinilpirrolidona, lauril sulfato de sódio e estearil fumarato de sódio. Além disso, o revestimento do filme contém os seguintes ingredientes inativos: álcool polivinílico, polietileno glicol, talco, dióxido de titânio, óxido de ferro vermelho e óxido de ferro preto.
topo
Farmacologia Clínica
Mecanismo de ação
Janumet
Janumet combina dois agentes anti-hiperglicêmicos com mecanismos de ação complementares para melhorar o controle glicêmico em pacientes com diabetes tipo 2: sitagliptina, um inibidor da dipeptidil peptidase-4 (DPP-4) e cloridrato de metformina, um membro da biguanida classe.
Sitagliptina
A sitagliptina é um inibidor da DPP-4, que acredita-se exercer suas ações em pacientes com diabetes tipo 2, diminuindo a inativação dos hormônios incretina. As concentrações dos hormônios intactos ativos são aumentadas pela sitagliptina, aumentando e prolongando a ação desses hormônios. Hormônios da incretina, incluindo peptídeo-1 do tipo glucagon (GLP-1) e insulinotrópico dependente de glicose polipeptídeo (GIP), são liberados pelo intestino ao longo do dia e os níveis aumentam em resposta para uma refeição. Esses hormônios são rapidamente inativados pela enzima DPP-4. As incretinas fazem parte de um sistema endógeno envolvido na regulação fisiológica da homeostase da glicose. Quando as concentrações de glicose no sangue são normais ou elevadas, o GLP-1 e o GIP aumentam a síntese de insulina e a liberação das células beta pancreáticas por vias de sinalização intracelular envolvendo AMP cíclico. O GLP-1 também reduz a secreção de glucagon das células alfa pancreáticas, levando à produção reduzida de glicose hepática. Ao aumentar e prolongar os níveis ativos de incretina, a sitagliptina aumenta a liberação de insulina e diminui os níveis de glucagon na circulação de maneira dependente da glicose. A sitagliptina demonstra seletividade para DPP-4 e não inibe a atividade de DPP-8 ou DPP-9 in vitro em concentrações próximas às de doses terapêuticas.
Cloridrato de metformina
A metformina é um agente anti-hiperglicêmico que melhora a tolerância à glicose em pacientes com diabetes tipo 2, diminuindo a glicose plasmática basal e pós-prandial. Seus mecanismos de ação farmacológica são diferentes de outras classes de agentes anti-hiperglicêmicos orais. A metformina diminui a produção hepática de glicose, diminui a absorção intestinal de glicose e melhora a sensibilidade à insulina, aumentando a captação e utilização periférica de glicose. Diferentemente das sulfonilureias, a metformina não produz hipoglicemia em pacientes com diabetes tipo 2 ou em indivíduos normais (exceto em circunstâncias especiais [ver Avisos e Precauções]) e não causa hiperinsulinemia. Com a terapia com metformina, a secreção de insulina permanece inalterada, enquanto os níveis de insulina em jejum e a resposta à insulina plasmática durante um dia podem realmente diminuir.
12.2 Farmacodinâmica
Sitagliptina
Geral
Em pacientes com diabetes tipo 2, a administração de sitagliptina levou à inibição da atividade da enzima DPP-4 por um período de 24 horas. Após uma carga oral de glicose ou uma refeição, essa inibição de DPP-4 resultou em um aumento de 2 a 3 vezes nos níveis circulantes de GLP-1 ativo e GIP, diminuição das concentrações de glucagon e aumento da responsividade da liberação de insulina à glicose, resultando em maior peptídeo C e insulina concentrações. O aumento da insulina com a diminuição do glucagon foi associado a concentrações mais baixas de glicose em jejum e excursão reduzida de glicose após uma carga oral de glicose ou uma refeição.
Co-administração de sitagliptina e cloridrato de metformina
Num estudo de dois dias em indivíduos saudáveis, a sitagliptina sozinha aumentou as concentrações ativas de GLP-1, enquanto a metformina aumentou as concentrações ativas e totais de GLP-1 em extensões semelhantes. A administração concomitante de sitagliptina e metformina teve um efeito aditivo nas concentrações ativas de GLP-1. A sitagliptina, mas não a metformina, aumentou as concentrações ativas de GIP. Não está claro o que esses achados significam para alterações no controle glicêmico em pacientes com diabetes tipo 2.
Em estudos com indivíduos saudáveis, a sitagliptina não diminuiu a glicose no sangue nem causou hipoglicemia.
Eletrofisiologia Cardíaca
Em um estudo cruzado randomizado e controlado por placebo, 79 indivíduos saudáveis receberam uma dose oral única de sitagliptina 100 mg, sitagliptina 800 mg (8 vezes a dose recomendada) e placebo. Na dose recomendada de 100 mg, não houve efeito no intervalo QTc obtido na concentração plasmática máxima, ou em qualquer outro momento do estudo. Após a dose de 800 mg, o aumento máximo na alteração média corrigida pelo placebo no QTc da linha de base às 3 horas após a dose foi de 8,0 ms. Este aumento não é considerado clinicamente significativo. Na dose de 800 mg, as concentrações plasmáticas máximas de sitagliptina foram aproximadamente 11 vezes maiores que as concentrações máximas após uma dose de 100 mg.
Em pacientes com diabetes tipo 2 administrados sitagliptina 100 mg (N = 81) ou sitagliptina 200 mg (N = 63) diariamente, há não houve alterações significativas no intervalo QTc com base nos dados de ECG obtidos no momento do pico esperado do plasma concentração.
Farmacocinética
Janumet
Os resultados de um estudo de bioequivalência em indivíduos saudáveis demonstraram que o Janumet (sitagliptina / metformina HCl) 50 mg / 500 mg e 50 mg / 1000 mg comprimidos combinados são bioequivalentes à co-administração das doses correspondentes de sitagliptina (JANUVIA™2) e cloridrato de metformina em comprimidos individuais.
Absorção
Sitagliptina
A biodisponibilidade absoluta da sitagliptina é de aproximadamente 87%. A administração concomitante de uma refeição rica em gordura com sitagliptina não teve efeito na farmacocinética da sitagliptina.
Cloridrato de metformina
A biodisponibilidade absoluta de um comprimido de 500 mg de cloridrato de metformina administrado em condições de jejum é de aproximadamente 50-60%. Estudos usando doses orais únicas de comprimidos de cloridrato de metformina 500 mg a 1500 mg e 850 mg a 2550 mg indicam que há falta de proporcionalidade da dose com doses crescentes, o que é devido à menor absorção do que a uma alteração na eliminação. Os alimentos diminuem a extensão e atrasam levemente a absorção da metformina, como mostra uma concentração plasmática média média aproximadamente 40% mais baixa (Cmax), uma área 25% menor sob a curva de concentração plasmática versus tempo (AUC) e um prolongamento de 35 minutos para atingir o pico da concentração plasmática (Tmax) após a administração de um único comprimido de metformina de 850 mg com alimentos, em comparação com a mesma força do comprimido administrada em jejum. A relevância clínica dessas diminuições é desconhecida.
Distribuição
Sitagliptina
O volume médio de distribuição no estado estacionário após uma dose intravenosa única de 100 mg de sitagliptina em indivíduos saudáveis é de aproximadamente 198 litros. A fração de sitagliptina ligada reversivelmente às proteínas plasmáticas é baixa (38%).
Cloridrato de metformina
O volume aparente de distribuição (V / F) de metformina após doses orais únicas de comprimidos de cloridrato de metformina 850 mg em média 654 ± 358 L. A metformina está desprezivelmente ligada às proteínas plasmáticas, em contraste com as sulfonilureias, que são mais de 90% ligadas às proteínas. A metformina é dividida em eritrócitos, provavelmente em função do tempo. Em doses clínicas habituais e esquemas de dosagem de comprimidos de cloridrato de metformina, as concentrações plasmáticas de metformina em estado estacionário são atingidas em 24 a 48 horas e geralmente são
Metabolismo
Sitagliptina
Aproximadamente 79% da sitagliptina é excretada inalterada na urina, sendo o metabolismo uma via menor de eliminação.
Depois de uma [14C] dose oral de sitagliptina, aproximadamente 16% da radioatividade foi excretada como metabólitos da sitagliptina. Seis metabolitos foram detectados em níveis vestigiais e não se espera que contribuam para a atividade inibidora da sitagliptina no DPP-4 no plasma. Estudos in vitro indicaram que a enzima primária responsável pelo metabolismo limitado da sitagliptina foi o CYP3A4, com contribuição do CYP2C8.
Cloridrato de metformina
Estudos de dose única intravenosa em indivíduos normais demonstram que a metformina é excretada inalterada no urina e não sofre metabolismo hepático (não foram identificados metabólitos em humanos) nem biliares excreção.
Excreção
Sitagliptina
Após a administração de uma via oral [14C] dose de sitagliptina em indivíduos saudáveis, aproximadamente 100% da radioatividade administrada foi eliminada nas fezes (13%) ou na urina (87%) dentro de uma semana após a administração. O terminal aparente t1/2 após uma dose oral de 100 mg de sitagliptina foi de aproximadamente 12,4 horas e a depuração renal foi de aproximadamente 350 mL / min.
A eliminação da sitagliptina ocorre principalmente por excreção renal e envolve secreção tubular ativa. A sitagliptina é um substrato para o transportador de ânion orgânico humano 3 (hOAT-3), que pode estar envolvido na eliminação renal da sitagliptina. A relevância clínica do hOAT-3 no transporte de sitagliptina não foi estabelecida. A sitagliptina também é um substrato da glicoproteína-p, que também pode estar envolvida na mediação da eliminação renal da sitagliptina. No entanto, a ciclosporina, um inibidor da glicoproteína p, não reduziu a depuração renal da sitagliptina.
Cloridrato de metformina
A depuração renal é aproximadamente 3,5 vezes maior que a depuração da creatinina, o que indica que a secreção tubular é a principal via de eliminação da metformina. Após administração oral, aproximadamente 90% do fármaco absorvido é eliminado pela via renal nas primeiras 24 horas, com uma meia-vida de eliminação plasmática de aproximadamente 6,2 horas. No sangue, a meia-vida de eliminação é de aproximadamente 17,6 horas, sugerindo que a massa eritrocitária pode ser um compartimento de distribuição.
Populações Especiais
Insuficiência renal
Janumet
Janumet não deve ser utilizado em doentes com insuficiência renal [ver Contra-indicações; Avisos e Precauções].
Sitagliptina
Foi observado um aumento de aproximadamente 2 vezes na AUC plasmática da sitagliptina em pacientes com insuficiência renal moderada e um aumento de aproximadamente 4 vezes foi observado aumento em pacientes com insuficiência renal grave, incluindo pacientes com DRT em hemodiálise, em comparação ao controle saudável normal assuntos.
Cloridrato de metformina
Em doentes com função renal diminuída (com base na depuração medida da creatinina), a semi-vida plasmática e sanguínea de metformina é prolongada e a depuração renal diminui proporcionalmente à diminuição da creatinina liberação.
Insuficiência hepática
Sitagliptina
Em pacientes com insuficiência hepática moderada (escore de Child-Pugh 7 a 9), a AUC e C médiasmax da sitagliptina aumentou aproximadamente 21% e 13%, respectivamente, em comparação com os controles pareados saudáveis após a administração de uma dose única de 100 mg de sitagliptina. Essas diferenças não são consideradas clinicamente significativas.
Não há experiência clínica em pacientes com insuficiência hepática grave (escore de Child-Pugh> 9).
Cloridrato de metformina
Não foram realizados estudos farmacocinéticos de metformina em pacientes com insuficiência hepática.
Gênero
Sitagliptina
O sexo não teve efeito clinicamente significativo na farmacocinética da sitagliptina com base em um composto análise dos dados farmacocinéticos da Fase I e em uma análise farmacocinética populacional da Fase I e Fase II dados.
Cloridrato de metformina
Os parâmetros farmacocinéticos da metformina não diferiram significativamente entre indivíduos normais e pacientes com diabetes tipo 2 quando analisados de acordo com o sexo. Da mesma forma, em estudos clínicos controlados em pacientes com diabetes tipo 2, o efeito anti-hiperglicêmico da metformina foi comparável em homens e mulheres.
Geriátrico
Sitagliptina
Quando os efeitos da idade na função renal são levados em consideração, a idade por si só não teve um efeito clínico. impacto significativo na farmacocinética da sitagliptina com base numa farmacocinética da população análise. Os indivíduos idosos (65 a 80 anos) apresentaram concentrações plasmáticas de sitagliptina aproximadamente 19% mais altas em comparação aos indivíduos mais jovens.
Cloridrato de metformina
Dados limitados de estudos farmacocinéticos controlados da metformina em idosos saudáveis sugerem que a depuração plasmática total da metformina diminui, a meia-vida é prolongada e Cmax é aumentado em comparação com indivíduos jovens saudáveis. A partir desses dados, parece que a alteração na farmacocinética da metformina com o envelhecimento é explicada principalmente por uma alteração na função renal (consulte GLUCOPHAGE3 informação de prescrição: FARMACOLOGIA CLÍNICA, Populações Especiais, Geriatria).
O tratamento com Janumet não deve ser iniciado em pacientes com idade <80 anos, a menos que a medição da depuração da creatinina demonstre que a função renal não está reduzida [ver Avisos e Precauções].
Pediatria
Não foram realizados estudos com Janumet em doentes pediátricos.
Raça
Sitagliptina
A raça não teve efeito clinicamente significativo na farmacocinética da sitagliptina com base em uma análise composta dados farmacocinéticos disponíveis, incluindo indivíduos de raça branca, hispânica, negra, asiática e outras raças grupos.
Cloridrato de metformina
Não foram realizados estudos dos parâmetros farmacocinéticos da metformina de acordo com a raça. Em estudos clínicos controlados de metformina em pacientes com diabetes tipo 2, o efeito anti-hiperglicêmico foi comparável em brancos (n = 249), negros (n = 51) e hispânicos (n = 24).
Índice de Massa Corporal (IMC)
Sitagliptina
O índice de massa corporal não teve efeito clinicamente significativo na farmacocinética da sitagliptina com base em um composto análise dos dados farmacocinéticos da Fase I e em uma análise farmacocinética populacional da Fase I e Fase II dados.
Interações medicamentosas
Sitagliptina e cloridrato de metformina
A administração concomitante de doses múltiplas de sitagliptina (50 mg) e metformina (1000 mg) administrada duas vezes ao dia não altera significativamente a farmacocinética da sitagliptina ou da metformina em pacientes com tipo 2 diabetes.
Não foram realizados estudos de interação farmacocinética com Janumet; no entanto, esses estudos foram realizados com os componentes individuais de Janumet (sitagliptina e cloridrato de metformina).
Sitagliptina
Avaliação in vitro das interações medicamentosas
A sitagliptina não é um inibidor das isozimas do CYP CYP3A4, 2C8, 2C9, 2D6, 1A2, 2C19 ou 2B6 e não é um indutor do CYP3A4. A sitagliptina é um substrato da glicoproteína p, mas não inibe o transporte da digoxina mediada pela glicoproteína p. Com base nesses resultados, é improvável que a sitagliptina cause interações com outros medicamentos que utilizam essas vias.
A sitagliptina não está extensivamente ligada às proteínas plasmáticas. Portanto, a propensão da sitagliptina a se envolver em interações medicamentosas clinicamente significativas mediadas pelo deslocamento da ligação às proteínas plasmáticas é muito baixa.
Avaliação in vivo das interações medicamentosas
Efeito da Sitagliptina em outras drogas
Em estudos clínicos, como descrito abaixo, a sitagliptina não alterou significativamente a farmacocinética da metformina, gliburida, sinvastatina, rosiglitazona, varfarina ou via oral. contraceptivos, fornecendo evidência in vivo de baixa propensão a causar interações medicamentosas com substratos do CYP3A4, CYP2C8, CYP2C9 e transportador catiônico orgânico (OUTUBRO).
Digoxina: A sitagliptina teve um efeito mínimo na farmacocinética da digoxina. Após a administração concomitante de 0,25 mg de digoxina com 100 mg de sitagliptina diariamente por 10 dias, a AUC plasmática da digoxina aumentou 11% e a C plasmáticamax em 18%.
Sulfonilureias: A farmacocinética de dose única de gliburida, um substrato do CYP2C9, não foi significativamente alterada em indivíduos que receberam doses múltiplas de sitagliptina. Interações clinicamente significativas não seriam esperadas com outras sulfonilureias (por exemplo, glipizida, tolbutamida e glimepirida) que, como a gliburida, são principalmente eliminadas pelo CYP2C9 [ver Avisos e Precauções].
Sinvastatina: A farmacocinética de dose única de sinvastatina, um substrato do CYP3A4, não foi significativamente alterada em indivíduos que receberam doses diárias múltiplas de sitagliptina. Portanto, a sitagliptina não é um inibidor do metabolismo mediado pelo CYP3A4.
Tiazolidinedionas: A farmacocinética de dose única de rosiglitazona não foi significativamente alterada nos indivíduos receber doses diárias múltiplas de sitagliptina, indicando que a sitagliptina não é um inibidor da CYP2C8 metabolismo.
Varfarina: doses diárias múltiplas de sitagliptina não alteraram significativamente a farmacocinética, avaliada pela medida de Enantiómeros de varfarina S (-) ou R (+) ou farmacodinâmica (avaliada pela medição do INR da protrombina) de uma dose única de varfarina. Como a S (-) varfarina é metabolizada principalmente pelo CYP2C9, esses dados também confirmam a conclusão de que a sitagliptina não é um inibidor do CYP2C9.
Contraceptivos orais: A coadministração com sitagliptina não alterou significativamente a farmacocinética no estado de equilíbrio da noretindrona ou etinilestradiol.
Efeito de outras drogas na sitagliptina
Os dados clínicos descritos abaixo sugerem que a sitagliptina não é suscetível a interações clinicamente significativas por medicamentos co-administrados.
Ciclosporina: Foi realizado um estudo para avaliar o efeito da ciclosporina, um potente inibidor da glicoproteína-p, na farmacocinética da sitagliptina. A administração concomitante de uma dose oral única de 100 mg de sitagliptina e uma dose oral única de 600 mg de ciclosporina aumentou a AUC e a Cmax da sitagliptina em aproximadamente 29% e 68%, respectivamente. Estas alterações modestas na farmacocinética da sitagliptina não foram consideradas clinicamente significativas. A depuração renal da sitagliptina também não foi significativamente alterada. Portanto, não seriam esperadas interações significativas com outros inibidores da glicoproteína p.
Cloridrato de metformina
[Vejo Interações medicamentosas]
topo
Toxicologia Não Clínica
Carcinogênese, mutagênese, comprometimento da fertilidade
Janumet
Não foram realizados estudos em animais com os produtos combinados em Janumet para avaliar carcinogênese, mutagênese ou comprometimento da fertilidade. Os seguintes dados são baseados nos resultados de estudos com sitagliptina e metformina individualmente.
Sitagliptina
Foi realizado um estudo de carcinogenicidade de dois anos em ratos machos e fêmeas que receberam doses orais de sitagliptina de 50, 150 e 500 mg / kg / dia. Houve um aumento da incidência de adenoma / carcinoma hepático combinado em homens e mulheres e de carcinoma hepático em mulheres a 500 mg / kg. Esta dose resulta em exposições aproximadamente 60 vezes superiores à exposição humana na dose diária máxima recomendada para adultos em humanos (MRHD) de 100 mg / dia, com base nas comparações da AUC. Não foram observados tumores hepáticos a 150 mg / kg, aproximadamente 20 vezes a exposição humana no MRHD. Foi realizado um estudo de carcinogenicidade de dois anos em camundongos machos e fêmeas que receberam doses orais de sitagliptina de 50, 125, 250 e 500 mg / kg / dia. Não houve aumento na incidência de tumores em nenhum órgão até 500 mg / kg, aproximadamente 70 vezes a exposição humana no MRHD. A sitagliptina não foi mutagênica ou clastogênica com ou sem ativação metabólica no ensaio de mutagenicidade bacteriana de Ames, um ovário de hamster chinês (CHO) ensaio de aberração cromossômica, ensaio citogenético in vitro em CHO, ensaio de eluição alcalina de DNA de hepatócito de rato in vitro e micronúcleo in vivo ensaio.
Em estudos de fertilidade em ratos com doses orais de gavagem de 125, 250 e 1000 mg / kg, os machos foram tratados por 4 semanas antes do acasalamento, durante acasalamento, até o término programado (total de aproximadamente 8 semanas) e as fêmeas foram tratadas 2 semanas antes do acasalamento através da gestação dia 7. Não foi observado efeito adverso na fertilidade em 125 mg / kg (aproximadamente 12 vezes a exposição humana no MRHD de 100 mg / dia com base nas comparações da AUC). Em doses mais altas, foram observadas reabsorções relacionadas à não-dose em mulheres (aproximadamente 25 e 100 vezes a exposição humana no MRHD com base na comparação da AUC).
Cloridrato de metformina
Estudos de carcinogenicidade a longo prazo foram realizados em ratos (duração da dose de 104 semanas) e camundongos (duração da dose de 91 semanas) em doses até 900 mg / kg / dia e 1500 mg / kg / dia, inclusive respectivamente. Estas doses são aproximadamente quatro vezes a dose diária máxima humana recomendada de 2000 mg, com base nas comparações da área da superfície corporal. Não foi encontrada evidência de carcinogenicidade com metformina em camundongos machos ou fêmeas. Da mesma forma, não houve potencial tumorigênico observado com a metformina em ratos machos. Houve, no entanto, um aumento da incidência de pólipos uterinos estromais benignos em ratas tratadas com 900 mg / kg / dia.
Não houve evidência de potencial mutagênico da metformina nos seguintes testes in vitro: Teste de Ames (S. typhimurium), teste de mutação genética (células de linfoma de camundongo) ou teste de aberrações cromossômicas (linfócitos humanos). Os resultados no teste de micronúcleo de camundongo in vivo também foram negativos. A fertilidade de ratos machos ou fêmeas não foi afetada pela metformina quando administrada em doses tão altas quanto 600 mg / kg / dia, que é aproximadamente três vezes a dose diária máxima recomendada em humanos, com base na área da superfície corporal comparações.
topo
Estudos clínicos
A coadministração de sitagliptina e metformina foi estudada em pacientes com diabetes tipo 2 inadequadamente controlados na dieta e exercício e em combinação com glimepirida.
Não houve estudos de eficácia clínica conduzidos com Janumet; no entanto, foi demonstrada a bioequivalência de Janumet com comprimidos de sitagliptina e cloridrato de metformina co-administrados.
Co-administração de sitagliptina e metformina em pacientes com diabetes tipo 2 inadequadamente controlados por dieta e exercício
Um total de 1091 pacientes com diabetes tipo 2 e controle glicêmico inadequado na dieta e exercício participou de 24 semanas, estudo fatorial randomizado, duplo-cego e controlado por placebo, desenvolvido para avaliar a eficácia da sitagliptina e da metformina co-administração. Os pacientes em uso de um agente anti-hiperglicêmico (N = 541) foram submetidos a um período de dieta, exercício e lavagem de medicamentos com duração de até 12 semanas. Após o período de lavagem, os pacientes com controle glicêmico inadequado (A1C de 7,5% a 11%) foram randomizados após completar um período de execução de duas semanas com placebo cego único. Pacientes não em uso de agentes anti-hiperglicêmicos na entrada do estudo (N = 550) com controle glicêmico inadequado (A1C 7,5% a 11%) entraram imediatamente no período inicial de placebo de 2 semanas e depois foram randomizado. Números aproximadamente iguais de pacientes foram randomizados para receber placebo, 100 mg de sitagliptina uma vez ao dia, 500 mg ou 1000 mg de metformina duas vezes ao dia ou 50 mg de sitagliptina duas vezes ao dia em combinação com 500 mg ou 1000 mg de metformina duas vezes diariamente. Pacientes que falharam em atingir objetivos glicêmicos específicos durante o estudo foram tratados com resgate de glibenclamida (glibenclamida).
A co-administração de sitagliptina e metformina proporcionou melhorias significativas no A1C, FPG e PPG de 2 horas em comparação ao placebo, apenas à metformina e apenas à sitagliptina (Tabela 3, Figura 1). As reduções médias da linha de base na A1C foram geralmente maiores para pacientes com valores mais altos da linha de base. Para pacientes que não usavam um agente anti-hiperglicêmico na entrada do estudo, as reduções médias da linha de base na A1C foram: sitagliptina 100 mg uma vez ao dia, -1,1%; metformina 500 mg bid, -1,1%; metformina 1000 mg bid, -1,2%; sitagliptina 50 mg bid com metformina 500 mg bid, -1,6%; sitagliptina 50 mg bid com metformina 1000 mg bid, -1,9%; e para pacientes que receberam placebo, -0,2%. Os efeitos lipídicos eram geralmente neutros. A diminuição do peso corporal nos grupos que receberam sitagliptina em combinação com metformina foi semelhante à dos grupos que receberam metformina em monoterapia ou placebo.
Tabela 3: Parâmetros glicêmicos na visita final (estudo de 24 semanas) para sitagliptina e metformina, isoladamente e em combinação em pacientes com diabetes tipo 2 inadequadamente controlados na dieta e exercício *
Placebo |
Sitagliptina 100 mg QD |
Metformina 500 mg bid |
Metformina Lance de 1000 mg |
Sitagliptina Oferta de 50 mg + Metformina 500 mg bid |
Sitagliptina Oferta de 50 mg + Metformina Lance de 1000 mg |
|
| ||||||
| A1C (%) | N = 165 | N = 175 | N = 178 | N = 177 | N = 183 | N = 178 |
| Linha de base (média) | 8.7 | 8.9 | 8.9 | 8.7 | 8.8 | 8.8 |
| Alteração da linha de base (média ajustada†) | 0.2 | -0.7 | -0.8 | -1.1 | -1.4 | -1.9 |
| Diferença do placebo (média ajustada†) (IC 95%) |
-0.8c (-1.1, -0.6) |
-1.0c (-1.2, -0.8) |
-1.3c (-1.5, -1.1) |
-1.6c (-1.8, -1.3) |
-2.1c (-2.3, -1.8) |
|
| Pacientes (%) atingindo A1C <7% | 15 (9%) | 35 (20%) | 41 (23%) | 68 (38%) | 79 (43%) | 118 (66%) |
| % De pacientes recebendo medicação de resgate | 32 | 21 | 17 | 12 | 8 | 2 |
| FPG (mg / dL) | N = 169 | N = 178 | N = 179 | N = 179 | N = 183 | N = 180 |
| Linha de base (média) | 196 | 201 | 205 | 197 | 204 | 197 |
| Alteração da linha de base (média ajustada†) | 6 | -17 | -27 | -29 | -47 | -64 |
| Diferença do placebo (média ajustada†) (IC 95%) |
-23c (-33, -14) |
-33c (-43, -24) |
-35c (-45, -26) |
-53c (-62, -43) |
-70c (-79, -60) |
|
| PPG de 2 horas (mg / dL) | N = 129 | N = 136 | N = 141 | N = 138 | N = 147 | N = 152 |
| Linha de base (média) | 277 | 285 | 293 | 283 | 292 | 287 |
| Alteração da linha de base (média ajustada†) | 0 | -52 | -53 | -78 | -93 | -117 |
| Diferença do placebo (média ajustada†) (IC 95%) |
-52c (-67, -37) |
-54c (-69, -39) |
-78c (-93, -63) |
-93c (-107, -78) |
-117c (-131, -102) |
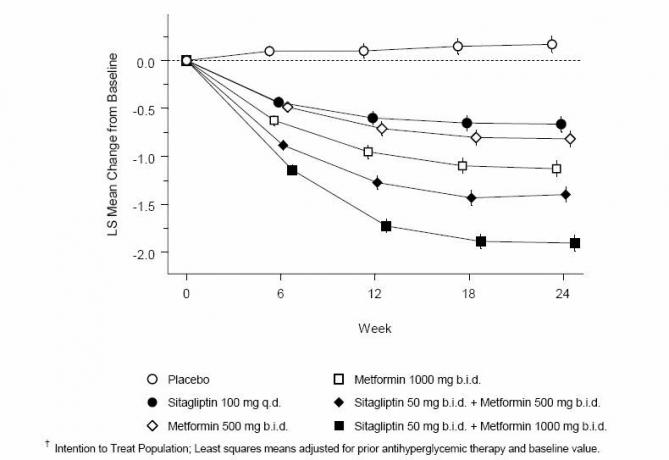
Figura 1: Alteração média da linha de base para A1C (%) ao longo de 24 semanas com sitagliptina e metformina, sozinho e em combinação em pacientes com diabetes tipo 2 inadequadamente controlados com dieta e exercício físico
Além disso, este estudo incluiu pacientes (N = 117) com hiperglicemia mais grave (A1C> 11% ou sangue) glicose> 280 mg / dL) tratados com sitagliptina duas vezes ao dia 50 mg e metformina 1000 mg. Nesse grupo de pacientes, o valor médio da A1C basal foi de 11,2%, o FPG médio foi de 314 mg / dL e o PPG médio de 2 horas foi de 441 mg / dL. Após 24 semanas, foram observadas reduções médias da linha de base de -2,9% para A1C, -127 mg / dL para FPG e -208 mg / dL para PPG de 2 horas.
A terapia combinada inicial ou a manutenção da terapia combinada devem ser individualizadas e são deixadas ao critério do médico.
Terapia adicional com sitagliptina em pacientes com diabetes tipo 2 inadequadamente controlada com metformina sozinha
Um total de 701 pacientes com diabetes tipo 2 participou de um estudo randomizado, duplo-cego e controlado por placebo, de 24 semanas, desenvolvido para avaliar a eficácia da sitagliptina em combinação com a metformina. Os pacientes que já usavam metformina (N = 431) em uma dose de pelo menos 1500 mg por dia foram randomizados após completar um período de execução de duas semanas, com ocultação de placebo. Pacientes em uso de metformina e outro agente anti-hiperglicêmico (N = 229) e pacientes em uso de nenhum agente anti-hiperglicêmico (sem terapia por pelo menos 8 semanas, N = 41) foram randomizados após um período de amaciamento de aproximadamente 10 semanas com metformina (a uma dose de pelo menos 1500 mg por dia) em monoterapia. Os pacientes foram randomizados para a adição de 100 mg de sitagliptina ou placebo, administrados uma vez ao dia. Pacientes que falharam em atingir objetivos glicêmicos específicos durante os estudos foram tratados com resgate de pioglitazona.
Em combinação com a metformina, a sitagliptina proporcionou melhorias significativas no A1C, FPG e PPG de 2 horas em comparação ao placebo com metformina (Tabela 4). A terapia glicêmica de resgate foi utilizada em 5% dos pacientes tratados com sitagliptina 100 mg e em 14% dos pacientes tratados com placebo. Uma diminuição semelhante no peso corporal foi observada nos dois grupos de tratamento.
Tabela 4: Parâmetros glicêmicos na visita final (estudo de 24 semanas) da sitagliptina na terapia combinada com metformina *
| Sitagliptina 100 mg, QD + Metformina |
Placebo + Metformina |
|
| ||
| A1C (%) | N = 453 | N = 224 |
| Linha de base (média) | 8.0 | 8.0 |
| Alteração da linha de base (média ajustada†) | -0.7 | -0.0 |
| Diferença de placebo + metformina (média ajustada†) (IC 95%) |
-0.7c (-0.8, -0.5) |
|
| Pacientes (%) atingindo A1C <7% | 213 (47%) | 41 (18%) |
| FPG (mg / dL) | N = 454 | N = 226 |
| Linha de base (média) | 170 | 174 |
| Alteração da linha de base (média ajustada†) | -17 | 9 |
| Diferença de placebo + metformina (média ajustada†) (IC 95%) |
-25c (-31, -20) |
|
| PPG de 2 horas (mg / dL) | N = 387 | N = 182 |
| Linha de base (média) | 275 | 272 |
| Alteração da linha de base (média ajustada†) | -62 | -11 |
| Diferença de placebo + metformina (média ajustada†) (IC 95%) |
-51c (-61, -41) |
Terapia adicional com sitagliptina em pacientes com diabetes tipo 2 inadequadamente controlada pela combinação de metformina e glimepirida
Um total de 441 pacientes com diabetes tipo 2 participaram de um estudo de 24 semanas, randomizado, duplo-cego, estudo controlado por placebo, projetado para avaliar a eficácia da sitagliptina em combinação com glimepirida, com ou sem metformina. Os pacientes entraram em um período de tratamento inicial apenas com glimepirida (<4 mg por dia) ou glimepirida em combinação com metformina (> 1500 mg por dia). Após um período de titulação da dose e de estabilização da dose de até 16 semanas e um período de 2 semanas do placebo, pacientes com insuficiência controle glicêmico (A1C 7,5% a 10,5%) foram randomizados para a adição de 100 mg de sitagliptina ou placebo, administrados uma vez diariamente. Pacientes que falharam em atingir objetivos glicêmicos específicos durante os estudos foram tratados com resgate de pioglitazona.
Os pacientes que receberam sitagliptina com metformina e glimepirida apresentaram melhorias significativas em A1C e FPG em comparação aos pacientes que receberam placebo com metformina e glimepirida (Tabela 5), com reduções médias da linha de base em relação ao placebo na A1C de -0,9% e na FPG de -21 mg / dL. A terapia de resgate foi usada em 8% dos pacientes tratados com sitagliptina 100 mg e 29% dos pacientes tratados com placebo adicional. Os pacientes tratados com sitagliptina suplementar tiveram um aumento médio no peso corporal de 1,1 kg vs. placebo adicional (+0,4 kg vs. -0,7 kg). Além disso, a sitagliptina adicional resultou em um aumento da taxa de hipoglicemia em comparação com o placebo adicional. [Vejo Avisos e Precauções; Reações adversas.]
Tabela 5: Parâmetros glicêmicos na visita final (estudo de 24 semanas) para sitagliptina em combinação com metformina e glimepirida *
| Sitagliptina 100 mg + Metformina e glimepirida |
Placebo + Metformina e glimepirida |
|
| ||
| A1C (%) | N = 115 | N = 105 |
| Linha de base (média) | 8.3 | 8.3 |
| Alteração da linha de base (média ajustada†) | -0.6 | 0.3 |
| Diferença do placebo (média ajustada†) (IC 95%) | -0.9c (-1.1, -0.7) |
|
| Pacientes (%) atingindo A1C <7% | 26 (23%) | 1 (1%) |
| FPG (mg / dL) | N = 115 | N = 109 |
| Linha de base (média) | 179 | 179 |
| Alteração da linha de base (média ajustada†) | -8 | 13 |
| Diferença do placebo (média ajustada†) (IC 95%) | -21c (-32, -10) |
Terapêutica complementar de sitagliptina vs. Terapia adicional com glipizida em pacientes com diabetes tipo 2 inadequadamente controlados com metformina
A eficácia da sitagliptina foi avaliada em um estudo de 52 semanas, duplo-cego e controlado pela glipizida, sem inferioridade, em pacientes com diabetes tipo 2. Pacientes que não estavam em tratamento ou em outros agentes anti-hiperglicêmicos entraram em um período de tratamento inicial de até 12 semanas de duração com metformina em monoterapia (dose de ¥ 1500 mg por dia), que incluiu lavagem de outros medicamentos que não a metformina, se aplicável. Após o período inicial, aqueles com controle glicêmico inadequado (A1C de 6,5% a 10%) foram randomizados 1: 1 com a adição de sitagliptina 100 mg uma vez ao dia ou glipizida por 52 semanas. Os pacientes que receberam glipizida receberam uma dose inicial de 5 mg / dia e, em seguida, titularam eletivamente durante as próximas 18 semanas para uma dose máxima de 20 mg / dia, conforme necessário para otimizar o controle glicêmico. Posteriormente, a dose de glipizida deveria ser mantida constante, exceto a titulação para evitar hipoglicemia. A dose média de glipizida após o período de titulação foi de 10 mg.
Após 52 semanas, a sitagliptina e a glipizida apresentaram reduções médias semelhantes da linha de base no A1C na análise de intenção de tratamento (Tabela 6). Esses resultados foram consistentes com a análise por protocolo (Figura 2). Uma conclusão a favor da não inferioridade da sitagliptina à glipizida pode ser limitada a pacientes com A1C comparável aos incluídos no estudo (mais de 70% dos pacientes tinham A1C basal <8% e mais de 90% tinham A1C <9%).
Tabela 6: Parâmetros glicêmicos em um estudo de 52 semanas comparando sitagliptina à glipizida como terapia adicional em pacientes controlados inadequadamente com metformina (população com intenção de tratar) *
| Sitagliptina 100 mg + Metformina |
Glipizida + Metformina |
|
| ||
| A1C (%) | N = 576 | N = 559 |
| Linha de base (média) | 7.7 | 7.6 |
| Alteração da linha de base (média ajustada†) | -0.5 | -0.6 |
| FPG (mg / dL) | N = 583 | N = 568 |
| Linha de base (média) | 166 | 164 |
| Alteração da linha de base (média ajustada†) | -8 | -8 |
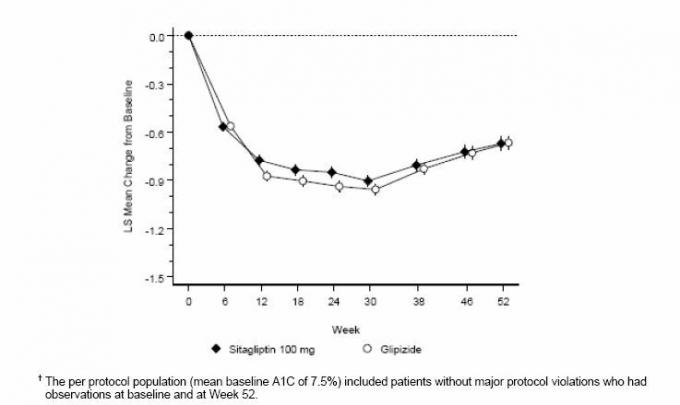
Figura 2: Alteração média da linha de base para A1C (%) ao longo de 52 semanas em um estudo comparando sitagliptina a Glipizida como terapia complementar em pacientes inadequadamente controlados com metformina (população por protocolo) â€
A incidência de hipoglicemia no grupo sitagliptina (4,9%) foi significativamente (p <0,001) menor do que no grupo glipizida (32,0%). Os pacientes tratados com sitagliptina exibiram uma diminuição média significativa da linha de base no peso corporal em comparação com um ganho de peso significativo nos pacientes que receberam glipizida (-1,5 kg vs. +1,1 kg).
topo
Como fornecido
No. 6747 - Comprimidos Janumet, 50 mg / 500 mg, são comprimidos revestidos por película rosa claro, em forma de cápsula, com "575" gravados numa das faces. Eles são fornecidos da seguinte maneira:
NDC 0006-0575-61 frascos de unidade de uso de 60
NDC 0006-0575-62 garrafas de unidade de uso de 180
NDC 0006-0575-52 blisters para dose unitária de 50
NDC 0006-0575-82 garrafas a granel de 1000.
6749 - Comprimidos Janumet, 50 mg / 1000 mg, são comprimidos revestidos por película, vermelhos, em forma de cápsula, com "577" gravados numa das faces. Eles são fornecidos da seguinte maneira:
NDC 0006-0577-61 frascos de unidade de uso de 60
NDC 0006-0577-62 garrafas de unidade de uso de 180
NDC 0006-0577-52 blisters para dose unitária de 50
NDC 0006-0577-82 garrafas a granel de 1000.
Armazene a 20-25 ° C (68-77 ° F), excursões permitidas a 15-30 ° C (59-86 ° F).
topo
Informações sobre aconselhamento ao paciente
Instruções
Os pacientes devem ser informados dos riscos e benefícios potenciais de Janumet e de modos alternativos de terapia. Devem também ser informados sobre a importância da adesão às instruções alimentares, atividade física regular, exames periódicos de sangue. monitoramento de glicose e teste de A1C, reconhecimento e tratamento de hipoglicemia e hiperglicemia e avaliação de diabetes complicações. Durante períodos de estresse, como febre, trauma, infecção ou cirurgia, os requisitos de medicação podem mudar e os pacientes devem ser aconselhados a procurar aconselhamento médico imediatamente.
Os riscos de acidose láctica devido ao componente metformina, seus sintomas e condições que predispõem ao seu desenvolvimento, conforme observado em Avisos e Precauções, deve ser explicado aos pacientes. Os pacientes devem ser aconselhados a interromper o Janumet imediatamente e notificar imediatamente seu médico se houver hiperventilação inexplicada, mialgia, mal-estar, sonolência incomum, tontura, batimento cardíaco lento ou irregular, sensação de frio (especialmente nas extremidades) ou outros sintomas não específicos ocorrer. Os sintomas gastrointestinais são comuns durante o início do tratamento com metformina e podem ocorrer durante o início da terapia com Janumet; no entanto, os pacientes devem consultar seu médico se desenvolverem sintomas inexplicáveis. Embora seja improvável que os sintomas gastrointestinais que ocorrem após a estabilização estejam relacionados a medicamentos, tal A ocorrência de sintomas deve ser avaliada para determinar se pode ser causada por acidose láctica ou outro doença.
Os pacientes devem ser aconselhados contra a ingestão excessiva de álcool, aguda ou crônica, enquanto estiverem recebendo Janumet.
Os pacientes devem ser informados sobre a importância de testar regularmente a função renal e os parâmetros hematológicos ao receber tratamento com Janumet.
Os pacientes devem ser informados de que foram relatadas reações alérgicas durante o uso pós-comercialização de sitagliptina, um dos componentes de Janumet. Se os sintomas de reações alérgicas (incluindo erupção cutânea, urticária e inchaço da face, lábios, língua e garganta dificuldade em respirar ou engolir), os pacientes devem parar de tomar Janumet e procurar orientação médica prontamente.
Os médicos devem instruir seus pacientes a ler o folheto informativo do paciente antes de iniciar a terapia com Janumet e a reler cada vez que a prescrição for renovada. Os pacientes devem ser instruídos a informar seu médico ou farmacêutico se desenvolverem algum sintoma incomum ou se algum sintoma conhecido persistir ou piorar.
Testes laboratoriais
A resposta a todas as terapias diabéticas deve ser monitorada por medições periódicas dos níveis de glicose no sangue e A1C, com o objetivo de diminuir esses níveis para a faixa normal. A1C é especialmente útil para avaliar o controle glicêmico a longo prazo.
Monitoramento inicial e periódico dos parâmetros hematológicos (por exemplo, hemoglobina / hematócrito e sangue vermelho índices celulares) e função renal (creatinina sérica) devem ser realizadas, pelo menos anualmente. Embora a anemia megaloblástica raramente tenha sido observada com a terapia com metformina, se houver suspeita, a deficiência de vitamina B12 deve ser excluída.
Distribuído por:
MERCK & CO., INC., Estação de Whitehouse, NJ 08889, EUA
9794108
Patente US: 6,699,871
1 Marca registrada da MERCK & CO., Inc., Whitehouse Station, Nova Jersey 08889 EUA
2 Marca registrada da MERCK & CO., Inc., Whitehouse Station, Nova Jersey 08889 EUA
3GLUCOPHAGE® é uma marca registrada da Merck Sante S.A.S, uma associada da Merck KGaA de Darmstadt, Alemanha.
Licenciado para a Bristol-Myers Squibb Company.
DIREITOS DE AUTOR © 2007, 2008 MERCK & CO., Inc.
Todos os direitos reservados
Rotulagem de paciente aprovada pela FDA
Informação do paciente
Janumet® (JAN-você-conheceu)
(sitagliptina / metformina HCl)
Comprimidos
Leia as informações do paciente que acompanham o Janumet1 antes de começar a tomá-las e sempre que receber um refil. Pode haver novas informações. Este folheto não substitui o de falar com o seu médico sobre a sua condição ou tratamento médico.
Qual é a informação mais importante que devo saber sobre o Janumet?
O cloridrato de metformina, um dos ingredientes de Janumet, pode causar um efeito colateral raro, mas sério, chamado acidose láctica (um acúmulo de ácido láctico no sangue) que pode causar a morte. A acidose láctica é uma emergência médica e deve ser tratada em um hospital.
Pare de tomar Janumet e chame seu médico imediatamente se tiver algum dos seguintes sintomas de acidose láctica:
- Você se sente muito fraco e cansado.
- Você tem dores musculares incomuns (não normais).
- Você tem dificuldade para respirar.
- Você tem problemas intestinais ou intestinais inexplicáveis com náuseas e vômitos ou diarréia.
- Você sente frio, especialmente nos braços e pernas.
- Você se sente tonto ou tonto.
- Você tem um batimento cardíaco lento ou irregular.
Você tem uma chance maior de sofrer acidose láctica se:
- tem problemas renais.
- tem problemas de fígado.
- tem insuficiência cardíaca congestiva que requer tratamento com medicamentos.
- beba muito álcool (muitas vezes ou beba a curto prazo).
- desidrate (perca uma grande quantidade de líquidos corporais). Isso pode acontecer se você estiver com febre, vômito ou diarréia. A desidratação também pode acontecer quando você sua muito com atividade ou exercício e não bebe líquidos suficientes.
- faça alguns exames de raio-x com corantes injetáveis ou agentes de contraste.
- faça cirurgia.
- tenha um ataque cardíaco, infecção grave ou derrame.
- tem 80 anos de idade ou mais e não testou a função renal.
O que é o Janumet?
Os comprimidos de Janumet contêm dois medicamentos sujeitos a receita médica, sitagliptina (JANUVIA ™ 2) e metformina. Janumet pode ser utilizado juntamente com dieta e exercício físico para reduzir o açúcar no sangue em pacientes adultos com diabetes tipo 2. O seu médico determinará se Janumet é adequado para você e a melhor maneira de começar e continuar a tratar seu diabetes.
Janumet:
- ajuda a melhorar os níveis de insulina após uma refeição.
- ajuda o corpo a responder melhor à insulina que produz naturalmente.
- diminui a quantidade de açúcar produzida pelo organismo.
- é improvável que cause baixo nível de açúcar no sangue (hipoglicemia) quando é tomado isoladamente para tratar o nível elevado de açúcar no sangue.
Janumet não foi estudado em crianças com menos de 18 anos de idade.
Janumet não foi estudado com insulina, um medicamento conhecido por causar baixos níveis de açúcar no sangue.
Quem não deve tomar Janumet?
Não tome Janumet se você:
- tem diabetes tipo 1.
- tem certos problemas renais.
- tem condições chamadas acidose metabólica ou cetoacidose diabética (aumento de cetonas no sangue ou na urina).
- tiveram uma reação alérgica a Janumet ou sitagliptina (JANUVIA), um dos componentes de Janumet.
- Se você receber uma injeção de corante ou agentes de contraste em um procedimento de raio-x, o Janumet precisará ser interrompido por um curto período de tempo. Converse com seu médico sobre quando parar Janumet e quando começar novamente. Consulte "Qual é a informação mais importante que devo saber sobre o Janumet?"
O que devo dizer ao meu médico antes e durante o tratamento com Janumet?
Janumet pode não ser o ideal para você. Informe o seu médico sobre todas as suas condições médicas, incluindo se você:
- tem problemas renais.
- tem problemas de fígado.
- tiveram uma reação alérgica a Janumet ou sitagliptina (JANUVIA), um dos componentes de Janumet.
- tem problemas cardíacos, incluindo insuficiência cardíaca congestiva.
- tem mais de 80 anos. Pacientes com mais de 80 anos de idade não devem tomar Janumet, a menos que sua função renal seja verificada e seja normal.
- beba muito álcool (o tempo todo ou bebedeira a curto prazo).
- está grávida ou planeja engravidar. Não se sabe se Janumet prejudicará seu bebê ainda não nascido. Se estiver grávida, converse com seu médico sobre a melhor maneira de controlar o açúcar no sangue enquanto estiver grávida. Se você usa Janumet durante a gravidez, converse com seu médico sobre como você pode estar no registro da Janumet. O número de telefone gratuito para o registro de gravidez é 1-800-986-8999.
- estão amamentando ou planejam amamentar. Não se sabe se Janumet vai passar para o leite materno. Converse com seu médico sobre a melhor maneira de alimentar seu bebê se estiver tomando Janumet.
Informe o seu médico sobre todos os medicamentos que você toma, incluindo medicamentos prescritos e não prescritos, vitaminas e suplementos de ervas. Janumet pode afetar o desempenho de outros medicamentos e alguns medicamentos podem afetar o desempenho do Janumet.
Conheça os medicamentos que você toma. Guarde uma lista dos seus medicamentos e mostre-a ao seu médico e farmacêutico quando receber um novo medicamento. Converse com seu médico antes de iniciar qualquer novo medicamento.
Como devo tomar Janumet?
- O seu médico dir-lhe-á quantos comprimidos Janumet tomar e com que frequência deve tomá-los. Tome Janumet exatamente como indicado pelo seu médico.
- O seu médico pode precisar aumentar a sua dose para controlar o açúcar no sangue.
- O seu médico pode receitar Janumet juntamente com uma sulfonilureia (outro medicamento para diminuir o açúcar no sangue). Consulte "Quais são os possíveis efeitos colaterais do Janumet?" para obter informações sobre o risco aumentado de baixo nível de açúcar no sangue.
- Tome Janumet com as refeições para diminuir a chance de dores de estômago.
- Continue a tomar Janumet desde que o seu médico o informe.
- Se você tomar Janumet em excesso, ligue para seu médico ou centro de controle de intoxicações imediatamente.
- Se você perder uma dose, tome-a com alimentos assim que se lembrar. Se você não se lembrar até a hora da próxima dose, pule a dose e volte ao seu horário normal. Não tome duas doses de Janumet ao mesmo tempo.
- Pode ser necessário parar de tomar Janumet por um curto período de tempo. Ligue para o seu médico para obter instruções se você:
- estão desidratados (perderam muito líquido corporal). A desidratação pode ocorrer se você estiver doente com vômitos graves, diarréia ou febre, ou se você bebe muito menos líquidos do que o normal.
- planeja fazer uma cirurgia.
- receberão uma injeção de corante ou agente de contraste para um procedimento de raio-x.
Consulte "Qual é a informação mais importante que devo saber sobre o Janumet?" e "Quem não deve tomar Janumet?"
- Quando seu corpo está sob alguns tipos de estresse, como febre, trauma (como um acidente de carro), infecção ou cirurgia, a quantidade de remédios para diabetes necessária pode mudar. Informe imediatamente o seu médico se tiver alguma destas condições e siga as instruções do seu médico.
- Monitore o açúcar no sangue conforme indicado pelo seu médico.
- Mantenha a sua dieta prescrita e programa de exercícios enquanto estiver a tomar Janumet.
- Converse com seu médico sobre como prevenir, reconhecer e gerenciar baixo nível de açúcar no sangue (hipoglicemia), alto nível de açúcar no sangue (hiperglicemia) e complicações do diabetes.
- O seu médico irá monitorizar a sua diabetes com análises ao sangue regulares, incluindo os seus níveis de açúcar no sangue e a sua hemoglobina A1C.
- O seu médico fará análises ao sangue para verificar a sua função renal antes e durante o tratamento com Janumet.
Quais são os possíveis efeitos colaterais do Janumet?
Janumet pode causar efeitos secundários graves. Consulte "Qual é a informação mais importante que devo saber sobre o Janumet?"
Os efeitos colaterais comuns ao tomar Janumet incluem:
- nariz entupido ou escorrendo e dor de garganta
- infecção respiratória superior
- diarréia
- nausea e vomito
- gás, desconforto estomacal, indigestão
- fraqueza
- dor de cabeça
Tomar Janumet nas refeições pode ajudar a reduzir os efeitos colaterais comuns da metformina no estômago, que geralmente ocorrem no início do tratamento. Se você tiver problemas estomacais incomuns ou inesperados, converse com seu médico. Problemas no estômago que começam mais tarde durante o tratamento podem ser um sinal de algo mais sério.
Certos medicamentos para diabetes, como sulfonilureias e meglitinidas, podem causar baixo nível de açúcar no sangue (hipoglicemia). Quando Janumet é utilizado com estes medicamentos, pode ter açúcar no sangue demasiado baixo. O seu médico pode prescrever doses mais baixas do medicamento sulfonilureia ou meglitinida. Informe o seu médico se tiver problemas com baixo nível de açúcar no sangue.
Os seguintes efeitos colaterais adicionais foram relatados em uso geral com Janumet ou sitagliptina:
- Podem ocorrer reações alérgicas graves com Janumet ou sitagliptina, um dos medicamentos em Janumet. Os sintomas de uma reação alérgica grave podem incluir erupção cutânea, urticária e inchaço da face, lábios, língua e garganta, dificuldade em respirar ou engolir. Se você tiver uma reação alérgica, pare de tomar Janumet e chame seu médico imediatamente. O seu médico pode prescrever um medicamento para tratar sua reação alérgica e um medicamento diferente para o diabetes.
- Enzimas hepáticas elevadas.
- Inflamação do pâncreas.
Estes não são todos os possíveis efeitos colaterais de Janumet. Para mais informações, consulte o seu médico.
Informe o seu médico se tiver algum efeito colateral que o incomode, seja incomum ou não desapareça.
Como devo guardar o Janumet?
Armazene Janumet à temperatura ambiente, 20-25 ° C (68-77 ° F).
Mantenha Janumet e todos os medicamentos fora do alcance de crianças.
Informações gerais sobre o uso do Janumet
Às vezes, os medicamentos são prescritos para condições que não são mencionadas nos folhetos de informações do paciente. Não use Janumet para uma condição para a qual não foi prescrito. Não dê Janumet a outras pessoas, mesmo que tenham os mesmos sintomas que você. Isso pode prejudicá-los.
Este folheto resume as informações mais importantes sobre o Janumet. Se você quiser saber mais informações, converse com seu médico. Pode pedir ao seu médico ou farmacêutico informações sobre o Janumet, escritas para profissionais de saúde. Para mais informações, ligue para 1-800-622-4477.
Quais são os ingredientes em Janumet?
Ingredientes ativos: sitagliptina e cloridrato de metformina.
Ingredientes inativos: celulose microcristalina, polivinilpirrolidona, lauril sulfato de sódio e estearil fumarato de sódio. O revestimento do filme para comprimidos contém os seguintes ingredientes inativos: álcool polivinílico, polietileno glicol, talco, dióxido de titânio, óxido de ferro vermelho e óxido de ferro preto.
O que é diabetes tipo 2?
O diabetes tipo 2 é uma condição em que seu corpo não produz insulina suficiente e a insulina que seu corpo produz não funciona tão bem quanto deveria. Seu corpo também pode produzir muito açúcar. Quando isso acontece, o açúcar (glicose) se acumula no sangue. Isso pode levar a sérios problemas médicos.
O principal objetivo do tratamento da diabetes é diminuir o açúcar no sangue para um nível normal. A redução e o controle do açúcar no sangue podem ajudar a prevenir ou retardar as complicações do diabetes, como problemas cardíacos, renais, cegueira e amputação.
O nível elevado de açúcar no sangue pode ser reduzido pela dieta, exercício e certos medicamentos quando necessário.
Emitido em março de 2009
Distribuído por:
MERCK & CO., INC., Estação de Whitehouse, NJ 08889, EUA
Última atualização: 03/09
Janumet, Sitagliptina e Cloridrato de Metformina, Informações ao Paciente (Em inglês simples)
Informações detalhadas sobre sinais, sintomas, causas, tratamentos da diabetes
As informações desta monografia não se destinam a cobrir todos os usos possíveis, instruções, precauções, interações medicamentosas ou efeitos adversos. Esta informação é generalizada e não se destina a aconselhamento médico específico. Se você tiver dúvidas sobre os medicamentos que está tomando ou quiser obter mais informações, consulte seu médico, farmacêutico ou enfermeiro.
de volta a: Procurar todos os medicamentos para diabetes



