Actos para Diabetes Tipo 2
Marca: Actos
Nome genérico: Cloridrato de pioglitazona
Conteúdo:
Descrição
Farmacologia
Indicações e uso
Contra-indicações
Advertências
Precauções
Reações adversas
Overdose
Dosagem e Administração
Como fornecido
Actos, pioglitazona hcl, informações para o paciente (Em inglês simples)
AVISO: FALHA CONGESTIVA DO CORAÇÃO
- As tiazolidinedionas, incluindo Actos, causam ou exacerbam insuficiência cardíaca congestiva em alguns pacientes (ver ADVERTÊNCIAS). Após o início do Actos e após o aumento da dose, observe cuidadosamente os pacientes quanto a sinais e sintomas de insuficiência cardíaca (incluindo ganho de peso excessivo e rápido, dispnéia e / ou edema). Se esses sinais e sintomas se desenvolverem, a insuficiência cardíaca deve ser gerenciada de acordo com os padrões atuais de atendimento. Além disso, deve ser considerada a descontinuação ou redução da dose de Actos.
- Actos não é recomendado em pacientes com insuficiência cardíaca sintomática. O início do Actos em pacientes com insuficiência cardíaca classe III ou IV da NYHA é contraindicado (consulte CONTRA-INDICAÇÕES e ADVERTÊNCIAS).
Descrição
Actos (cloridrato de pioglitazona) é um agente antidiabético oral que atua principalmente diminuindo a resistência à insulina. Actos é usado no tratamento do diabetes mellitus tipo 2 (também conhecido como diabetes mellitus não dependente de insulina [NIDDM] ou diabetes de início no adulto). Estudos farmacológicos indicam que o Actos melhora a sensibilidade à insulina no tecido muscular e adiposo e inibe a gliconeogênese hepática. Actos melhora o controle glicêmico enquanto reduz os níveis circulantes de insulina.
O monohidrocloreto de pioglitazona [(±) -5 - [[4- [2- (5-etil-2-piridinil) etoxi] fenil] metil] -2,4-] tiazolidinediona pertence a um classe química diferente e tem uma ação farmacológica diferente das sulfonilureias, da metformina ou da a-glucosidase inibidores. A molécula contém um carbono assimétrico, e o composto é sintetizado e usado como a mistura racêmica. Os dois enantiómeros da pioglitazona interconvertem in vivo. Não foram encontradas diferenças na atividade farmacológica entre os dois enantiômeros. A fórmula estrutural é como mostrado:
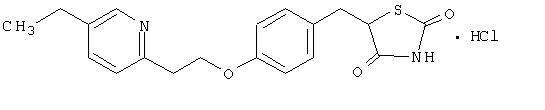
O cloridrato de pioglitazona é um pó cristalino branco inodoro que possui uma fórmula molecular de C19H20N2O3S-HCl e um peso molecular de 392,90 daltons. É solúvel em N, N-dimetilformamida, levemente solúvel em etanol anidro, muito levemente solúvel em acetona e acetonitrila, praticamente insolúvel em água e insolúvel em éter.
Actos está disponível como um comprimido para administração oral contendo 15 mg, 30 mg ou 45 mg de pioglitazona (como base) formulada com os seguintes excipientes: lActose monohidratada NF, hidroxipropilcelulose NF, carboximetilcelulose cálcio NF e estearato de magnésio NF.
topo
Farmacologia Clínica
Mecanismo de ação
Actos é um agente antidiabético da tiazolidinediona que depende da presença de insulina para o seu mecanismo de ação. Actos diminui a resistência à insulina na periferia e no fígado, resultando em maior disposição de glicose dependente de insulina e menor produção de glicose hepática. Ao contrário das sulfonilureias, a pioglitazona não é um secretagogo de insulina. A pioglitazona é um potente agonista do receptor gama ativado por proliferador de peroxissomo (PPARy). Os receptores PPAR são encontrados em tecidos importantes para a ação da insulina, como tecido adiposo, músculo esquelético e fígado. A ativação dos receptores nucleares de PPARy modula a transcrição de vários genes responsivos à insulina envolvidos no controle do metabolismo da glicose e lipídios.
Em modelos animais de diabetes, a pioglitazona reduz a hiperglicemia, hiperinsulinemia e hipertrigliceridemia característica de estados resistentes à insulina, como diabetes tipo 2. As alterações metabólicas produzidas pela pioglitazona resultam em maior responsividade dos tecidos dependentes de insulina e são observadas em vários modelos animais de resistência à insulina.
Como a pioglitazona aumenta os efeitos da insulina circulante (diminuindo a resistência à insulina), ela não diminui a glicose no sangue em modelos animais que não possuem insulina endógena.
Farmacocinética e metabolismo de medicamentos
As concentrações séricas de pioglitazona total (pioglitazona mais metabólitos ativos) permanecem elevadas 24 horas após a administração uma vez ao dia. As concentrações séricas no estado estacionário da pioglitazona e da pioglitazona total são atingidas no prazo de 7 dias. No estado estacionário, dois dos metabolitos farmacologicamente ativos da pioglitazona, os metabólitos III (M-III) e IV (M-IV), atingem concentrações séricas iguais ou superiores à pioglitazona. Em voluntários saudáveis e em pacientes com diabetes tipo 2, a pioglitazona compreende aproximadamente 30% a 50% da concentrações séricas totais máximas de pioglitazona e 20% a 25% da área total sob a curva tempo-concentração sérica (AUC).
Concentração sérica máxima (Cmax), AUC e concentrações séricas mínimas (Cmin) para a pioglitazona e a pioglitazona total aumentam proporcionalmente nas doses de 15 mg e 30 mg por dia. Existe um aumento ligeiramente inferior à proporcional para a pioglitazona e a pioglitazona total na dose de 60 mg por dia.
Absorção: Após administração oral, em jejum, a pioglitazona é primeiro mensurável no soro em 30 minutos, com concentrações máximas observadas em 2 horas. Os alimentos atrasam levemente o tempo de pico da concentração sérica para 3 a 4 horas, mas não alteram a extensão da absorção.
Distribuição: O volume médio aparente de distribuição (Vd / F) da pioglitazona após administração de dose única é 0,63 ± 0,41 (média ± DP) L / kg de peso corporal.
A pioglitazona é extensivamente ligada às proteínas (> 99%) no soro humano, principalmente à albumina sérica. A pioglitazona também se liga a outras proteínas séricas, mas com menor afinidade. Os metabólitos M-III e M-IV também estão extensivamente ligados (> 98%) à albumina sérica.
Metabolismo: A pioglitazona é extensivamente metabolizada por hidroxilação e oxidação; os metabólitos também se convertem parcialmente em conjugados de glucuronídeo ou sulfato. Os metabólitos M-II e M-IV (derivados hidroxi da pioglitazona) e M-III (derivado ceto da pioglitazona) são farmacologicamente ativos em modelos animais de diabetes tipo 2. Além da pioglitazona, M-III e M-IV são as principais espécies relacionadas a medicamentos encontradas no soro humano após doses múltiplas. No estado estacionário, em voluntários saudáveis e em pacientes com diabetes tipo 2, a pioglitazona compreende aproximadamente 30% a 50% do pico total das concentrações séricas e 20% a 25% da AUC total.
Dados in vitro demonstram que múltiplas isoformas do CYP estão envolvidas no metabolismo da pioglitazona. As isoformas do citocromo P450 envolvidas são o CYP2C8 e, em menor grau, o CYP3A4, com contribuições adicionais de uma variedade de outras isoformas, incluindo principalmente o CYP1A1 extra-hepático. Foram realizados estudos in vivo de pioglitazona em combinação com inibidores e substratos da P450 (ver Interações medicamentosas). As razões urinárias de 6-hidroxicortisol / cortisol medidas em pacientes tratados com Actos mostraram que a pioglitazona não é um forte indutor da enzima CYP3A4.
Excreção e eliminação: Após administração oral, aproximadamente 15% a 30% da dose de pioglitazona é recuperada na urina. A eliminação renal da pioglitazona é insignificante, e a droga é excretada principalmente como metabólitos e seus conjugados. Presume-se que a maior parte da dose oral seja excretada na bílis inalterada ou como metabólitos e eliminada nas fezes.
A meia-vida sérica média da pioglitazona e da pioglitazona total varia de 3 a 7 horas e 16 a 24 horas, respectivamente. A pioglitazona tem uma depuração aparente, CL / F, calculada em 5 a 7 l / h.
Populações Especiais
Insuficiência renal: a meia-vida de eliminação sérica da pioglitazona, M-III e M-IV permanece inalterada em pacientes com (depuração da creatinina de 30 a 60 mL / min) a insuficiência renal grave (depuração da creatinina <30 mL / min) quando comparada à normal assuntos. Não é recomendado ajuste da dose em doentes com disfunção renal (ver DOSAGEM E ADMINISTRAÇÃO).
Insuficiência hepática: Em comparação com controles normais, indivíduos com insuficiência hepática (grau B / C de Child-Pugh) apresentam redução aproximada de 45% na pioglitazona e pioglitazona total das concentrações médias de pico, mas nenhuma alteração na AUC média valores.
A terapia com Actos não deve ser iniciada se o paciente apresentar evidência clínica de doença hepática ativa ou se os níveis séricos de transaminase (ALT) excederem 2,5 vezes o limite superior do normal (ver PRECAUÇÕESEfeitos Hepáticos).
Idosos: em idosos saudáveis, as concentrações séricas máximas de pioglitazona e pioglitazona total não são significativamente diferentes, mas os valores da AUC são ligeiramente mais altos e os valores da meia-vida terminal são ligeiramente mais longos assuntos mais jovens. Essas mudanças não eram de magnitude que seriam consideradas clinicamente relevantes.
Pediatria: dados farmacocinéticos na população pediátrica não estão disponíveis.
Sexo: A média Cmax e os valores da AUC aumentaram de 20% a 60% no sexo feminino. Como monoterapia e em combinação com sulfonilureia, metformina ou insulina, o Actos melhorou o controle glicêmico em homens e mulheres. Em ensaios clínicos controlados, a hemoglobina A1c (HbA1c) as reduções em relação à linha de base foram geralmente maiores para mulheres do que para homens (diferença média média de HbA1c 0.5%). Como a terapia deve ser individualizada para cada paciente para alcançar o controle glicêmico, nenhum ajuste de dose é recomendado com base apenas no sexo.
Etnia: Dados farmacocinéticos entre vários grupos étnicos não estão disponíveis.
Interações medicamentosas
Os seguintes medicamentos foram estudados em voluntários saudáveis com uma administração concomitante de Actos 45 mg uma vez ao dia. Listados abaixo estão os resultados:
Contraceptivos orais: coadministração de Actos (45 mg uma vez ao dia) e um contraceptivo oral (1 mg de noretindrona mais 0,035 mg de etinilestradiol uma vez ao dia) por 21 dias, resultou em diminuição de 11% e 11-14% na AUC do etinilestradiol (0-24h) e Cmax respectivamente. Não houve alterações significativas na AUC da noretindrona (0-24h) e Cmax. Tendo em vista a alta variabilidade da farmacocinética do etinilestradiol, o significado clínico desse achado é desconhecido.
Fexofenadina HCl: A administração concomitante de Actos por 7 dias com 60 mg de fexofenadina administrada por via oral duas vezes ao dia não resultou em efeito significativo na farmacocinética da pioglitazona. Actos não teve efeito significativo na farmacocinética da fexofenadina.
Glipizida: A administração concomitante de Actos e 5 mg de glipizida administrada por via oral uma vez ao dia por 7 dias não alterou a farmacocinética em estado estacionário da glipizida.
Digoxina: A administração concomitante de Actos com 0,25 mg de digoxina administrada por via oral uma vez ao dia por 7 dias não alterou a farmacocinética no estado estacionário da digoxina.
Varfarina: A administração concomitante de Actos por 7 dias com varfarina não alterou a farmacocinética no estado estacionário da varfarina. Actos não tem efeito clinicamente significativo no tempo de protrombina quando administrado a pacientes recebendo terapia crônica com varfarina.
Metformina: A administração concomitante de uma dose única de metformina (1000 mg) e Actos após 7 dias de Actos não alterou a farmacocinética da dose única de metformina.
Midazolam: A administração de Actos por 15 dias, seguida de uma dose única de 7,5 mg de xarope de midazolam, resultou em uma redução de 26% no midazolam Cmax e AUC.
Ranitidina HCl: A administração concomitante de Actos por 7 dias com ranitidina administrada por via oral duas vezes ao dia por 4 ou 7 dias não resultou em efeito significativo na farmacocinética da pioglitazona. Actos não mostrou efeito significativo na farmacocinética da ranitidina.
Nifedipina ER: Co-administração de Actos por 7 dias com 30 mg de nifedipina ER administrada por via oral uma vez ao dia por 4 dias a voluntários masculinos e femininos resultaram em valores médios mínimos quadrados (IC de 90%) para nifedipina inalterada de 0,83 (0,73 - 0,95) para Cmax e 0,88 (0,80-0,96) para AUC. Tendo em vista a alta variabilidade da farmacocinética da nifedipina, o significado clínico desse achado é desconhecido.
Cetoconazol: Co-administração de Actos por 7 dias com cetoconazol 200 mg administrado duas vezes diariamente resultou em valores médios mínimos quadrados (90% CI) para pioglitazona inalterada de 1,14 (1,06 - 1,23) para Cmax, 1,34 (1,26 - 1,41) para AUC e 1,87 (1,71 - 2,04) para Cmin.
Atorvastatina Cálcio: Co-administração de Actos por 7 dias com atorvastatina cálcica (LIPITOR®) 80 mg uma vez por dia resultou em valores médios mínimos quadrados (90% CI) para pioglitazona inalterada de 0,69 (0,57 - 0,85) para Cmax, 0,76 (0,65 - 0,88) para AUC e 0,96 (0,87 - 1,05) para Cmin. Para atorvastatina inalterada, os valores médios mínimos quadrados (IC de 90%) foram de 0,77 (0,66 - 0,90) para Cmax, 0,86 (0,78 - 0,94) para AUC e 0,92 (0,82 - 1,02) para Cmin.
Teofilina: A administração concomitante de Actos por 7 dias com teofilina 400 mg administrada duas vezes ao dia não resultou em alterações na farmacocinética de nenhum dos medicamentos.
Citocromo P450: Consulte PRECAUÇÕES
Gemfibrozil: administração concomitante de gemfibrozil (600 mg por via oral duas vezes ao dia), um inibidor do CYP2C8, com pioglitazona (30 mg por via oral) em 10 voluntários saudáveis pré-tratados por 2 dias antes com gemfibrozil (600 mg por via oral duas vezes ao dia) resultou em exposição à pioglitazona (AUC0-24) sendo 226% da exposição à pioglitazona na ausência de gemfibrozil (Vejo PRECAUÇÕES).
Rifampicina: administração concomitante de rifampicina (600 mg por via oral uma vez ao dia), um indutor do CYP2C8 com pioglitazona (30 mg por via oral) em 10 voluntários pré-tratados por 5 dias antes com rifampicina (600 mg por via oral uma vez ao dia) resultaram em uma redução na AUC da pioglitazona em 54% (ver PRECAUÇÕES).
Farmacodinâmica e efeitos clínicos
Estudos clínicos demonstram que o Actos melhora a sensibilidade à insulina em pacientes resistentes à insulina. Actos aumenta a capacidade de resposta celular à insulina, aumenta a disposição de glicose dependente de insulina, melhora a sensibilidade hepática à insulina e melhora a homeostase disfuncional da glicose. Em pacientes com diabetes tipo 2, a diminuição da resistência à insulina produzida pelo Actos resulta em menores concentrações plasmáticas de glicose, menores níveis plasmáticos de insulina e menor HbA1c valores. Com base nos resultados de um estudo de extensão de rótulo aberto, os efeitos do Actos na redução da glicose parecem persistir por pelo menos um ano. Em ensaios clínicos controlados, o Actos em combinação com sulfonilureia, metformina ou insulina teve um efeito aditivo no controle glicêmico.
Pacientes com anormalidades lipídicas foram incluídos em ensaios clínicos com Actos. No geral, os pacientes tratados com Actos apresentaram reduções médias em triglicerídeos, aumentos médios no colesterol HDL e nenhuma alteração média consistente no LDL e no colesterol total.
Em um estudo de 26 semanas, controlado por placebo, com intervalo de doses, os níveis médios de triglicerídeos diminuíram nos grupos de 15 mg, 30 mg e 45 mg de dose de Actos em comparação com um aumento médio no grupo placebo. Os níveis médios de HDL aumentaram em maior extensão nos pacientes tratados com Actos do que nos pacientes tratados com placebo. Não houve diferenças consistentes para LDL e colesterol total em pacientes tratados com Actos em comparação com placebo (Tabela 1).
Tabela 1 Lipídios em um estudo de 26 semanas com dose controlada em monoterapia e controlado por placebo
| Placebo | Actos 15 mg Uma vez Diariamente |
Actos 30 mg Uma vez Diariamente |
Actos 45 mg Uma vez Diariamente |
|
| Triglicerídeos (mg / dL) | N = 79 | N = 79 | N = 84 | N = 77 |
| Linha de base (média) | 262.8 | 283.8 | 261.1 | 259.7 |
| Variação percentual da linha de base (média) | 4.8% | -9.0% | -9.6% | -9.3% |
| Colesterol HDL (mg / dL) | N = 79 | N = 79 | N = 83 | N = 77 |
| Linha de base (média) | 41.7 | 40.4 | 40.8 | 40.7 |
| Variação percentual da linha de base (média) | 8.1% | 14.1% | 12.2% | 19.1% |
| Colesterol LDL (mg / dL) | N = 65 | N = 63 | N = 74 | N = 62 |
| Linha de base (média) | 138.8 | 131.9 | 135.6 | 126.8 |
| Variação percentual da linha de base (média) | 4.8% | 7.2% | 5.2% | 6.0% |
| Colesterol total (mg / dL) | N = 79 | N = 79 | N = 84 | N = 77 |
| Linha de base (média) | 224.6 | 220.0 | 222.7 | 213.7 |
| Variação percentual da linha de base (média) | 4.4% | 4.6% | 3.3% | 6.4% |
Nos dois outros estudos em monoterapia (24 semanas e 16 semanas) e em estudos de terapia combinada com sulfonilureia (24 semanas e 16 semanas) e metformina (24 semanas e 16 semanas), os resultados foram geralmente consistentes com os dados acima. Em ensaios controlados com placebo, as alterações médias corrigidas pelo placebo da linha de base diminuíram 5% a 26% para triglicerídeos e aumentaram 6% a 13% para HDL em pacientes tratados com Actos. Um padrão semelhante de resultados foi observado em estudos de terapia combinada de 24 semanas de Actos com sulfonilureia ou metformina.
Em um estudo de terapia combinada com insulina (16 semanas), a alteração percentual média corrigida pelo placebo, em relação aos valores basais nos triglicerídeos para pacientes tratados com Actos, também foi diminuída. Foi observada uma alteração média corrigida por placebo da linha de base no colesterol LDL de 7% para o grupo de dose de 15 mg. Resultados semelhantes aos observados acima para HDL e colesterol total foram observados. Um padrão semelhante de resultados foi observado em um estudo de terapia combinada de 24 semanas com o Actos com insulina.
Estudos clínicos
Monoterapia
Nos EUA, três estudos randomizados, duplo-cegos, controlados por placebo, com durações de 16 a 26 semanas, foram conduzidos para avaliar o uso de Actos como monoterapia em pacientes com diabetes tipo 2. Estes estudos examinaram o Actos em doses de até 45 mg ou placebo uma vez ao dia em 865 pacientes.
Em um estudo de 26 semanas, com doses variadas, 408 pacientes com diabetes tipo 2 foram randomizados para receber 7,5 mg, 15 mg, 30 mg ou 45 mg de Actos ou placebo uma vez ao dia. A terapia com qualquer agente antidiabético anterior foi descontinuada 8 semanas antes do período duplo-cego. O tratamento com 15 mg, 30 mg e 45 mg de Actos produziu melhorias estatisticamente significativas na HbA1c e na glicemia de jejum (FPG) no endpoint em comparação ao placebo (Figura 1, Tabela 2).
A Figura 1 mostra o curso de tempo para alterações no FPG e HbA1c para toda a população do estudo neste estudo de 26 semanas.
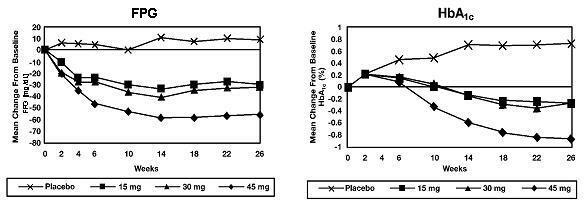
A tabela 2 mostra HbA1c e valores de FPG para toda a população do estudo.
Tabela 2 Parâmetros glicêmicos em um estudo de 26 semanas com intervalo de dose controlado por placebo
| Placebo | Actos 15 mg Uma vez Diariamente |
Actos 30 mg Uma vez Diariamente |
Actos 45 mg Uma vez Diariamente |
|
| POPULAÇÃO TOTAL | ||||
| HbA1c (%) | N = 79 | N = 79 | N = 85 | N = 76 |
| Linha de base (média) | 10.4 | 10.2 | 10.2 | 10.3 |
| Alteração da linha de base (média ajustada+) | 0.7 | -0.3 | -0.3 | -0.9 |
| Diferença do placebo (média ajustada+) | -1.0* | -1.0* | -1.6* | |
| FPG (mg / dL) | N = 79 | N = 79 | N = 84 | N = 77 |
| Linha de base (média) | 268 | 267 | 269 | 276 |
| Alteração da linha de base (média ajustada+) | 9 | -30 | -32 | -56 |
| Diferença do placebo (média ajustada+) | -39* | -41* | -65* | |
|
+ Ajustado para linha de base, centro combinado e centro combinado pela interação do tratamento * p <0,050 vs. placebo |
A população do estudo incluiu pacientes não tratados previamente com medicação antidiabética (ingênua; 31%) e pacientes que estavam recebendo medicação antidiabética no momento da inscrição no estudo (tratado anteriormente; 69%). Os dados para os subconjuntos de pacientes ingênuos e tratados anteriormente são mostrados na Tabela 3. Todos os pacientes entraram em um período de 8 semanas de washout / run-in antes do tratamento duplo-cego. Esse período de amaciamento foi associado a pouca alteração na HbA1c e valores de FPG da triagem à linha de base para os pacientes ingênuos; no entanto, para o grupo tratado anteriormente, a lavagem de medicamentos antidiabéticos anteriores resultou em deterioração do controle glicêmico e aumento da HbA1c e FPG. Embora a maioria dos pacientes no grupo tratado anteriormente tenha diminuído da linha de base na HbA1c e FPG com Actos, em muitos casos, os valores não retornaram aos níveis de triagem ao final do estudo. O desenho do estudo não permitiu a avaliação de pacientes que mudaram diretamente para o Actos de outro antidiabético.
Tabela 3 Parâmetros glicêmicos em um estudo de 26 semanas com intervalo de dose controlado por placebo
| Placebo | Actos 15 mg Uma vez Diariamente |
Actos 30 mg Uma vez Diariamente |
Actos 45 mg Uma vez Diariamente |
|
| Inveja à Terapia HbA1c (%) |
N = 25 | N = 26 | N = 26 | N = 21 |
| Triagem (média) | 9.3 | 10.0 | 9.5 | 9.8 |
| Linha de base (média) | 9.0 | 9.9 | 9.3 | 10.0 |
| Alteração da linha de base (média ajustada *) | 0.6 | -0.8 | -0.6 | -1.9 |
| Diferença do placebo (média ajustada *) | -1.4 | -1.3 | -2.6 | |
| FPG (mg / dL) | N = 25 | N = 26 | N = 26 | N = 21 |
| Triagem (média) | 223 | 245 | 239 | 239 |
| Linha de base (média) | 229 | 251 | 225 | 235 |
| Alteração da linha de base (média ajustada *) | 16 | -37 | -41 | -64 |
| Diferença do placebo (média ajustada *) | -52 | -56 | -80 | |
| Tratados anteriormente HbA1c (%) |
N = 54 | N = 53 | N = 59 | N = 55 |
| Triagem (média) | 9.3 | 9.0 | 9.1 | 9.0 |
| Linha de base (média) | 10.9 | 10.4 | 10.4 | 10.6 |
| Alteração da linha de base (média ajustada *) | 0.8 | -0.1 | -0.0 | -0.6 |
| Diferença do placebo (média ajustada *) | -1.0 | -0.9 | -1.4 | |
| FPG (mg / dL) | N = 54 | N = 53 | N = 58 | N = 56 |
| Triagem (média) | 222 | 209 | 230 | 215 |
| Linha de base (média) | 285 | 275 | 286 | 292 |
| Alteração da linha de base (média ajustada *) | 4 | -32 | -27 | -55 |
| Diferença do placebo (média ajustada *) | -36 | -31 | -59 | |
| * Ajustado para a linha de base e o centro de pool |
Em um estudo controlado por placebo de 24 semanas, 260 pacientes com diabetes tipo 2 foram randomizados para um dos dois grupos de tratamento Actos de titulação forçada ou um grupo placebo de titulação simulada. A terapia com qualquer agente antidiabético anterior foi descontinuada 6 semanas antes do período duplo-cego. Em um grupo de tratamento Actos, os pacientes receberam uma dose inicial de 7,5 mg uma vez ao dia. Após quatro semanas, a dose foi aumentada para 15 mg uma vez ao dia e após outras quatro semanas, a dose foi aumentada para 30 mg uma vez ao dia pelo restante do estudo (16 semanas). No segundo grupo de tratamento Actos, os pacientes receberam uma dose inicial de 15 mg uma vez ao dia e foram titulados para 30 mg uma vez ao dia e 45 mg uma vez ao dia de maneira semelhante. O tratamento com Actos, como descrito, produziu melhorias estatisticamente significativas na HbA1c e FPG no endpoint comparado ao placebo (Tabela 4).
Tabela 4 Parâmetros glicêmicos em um estudo de titulação forçada controlada por placebo de 24 semanas
| Placebo | Actos 30 mg+ Uma vez por dia |
Actos 45 mg+ Uma vez por dia |
|
| População total HbA1c (%) |
N = 83 | N = 85 | N = 85 |
| Linha de base (média) | 10.8 | 10.3 | 10.8 |
| Alteração da linha de base (média ajustada++) | 0.9 | -0.6 | -0.6 |
| Diferença do placebo (média ajustada++) | -1.5* | -1.5* | |
| FPG (mg / dL) | N = 78 | N = 82 | N = 85 |
| Linha de base (média) | 279 | 268 | 281 |
| Alteração da linha de base (média ajustada++) | 18 | -44 | -50 |
| Diferença do placebo (média ajustada++) | -62* | -68* | |
|
+ Dose final em titulação forçada ++ Ajustado para linha de base, centro combinado e centro combinado pela interação do tratamento * p <0,050 vs. placebo |
Para pacientes que não haviam sido tratados anteriormente com medicação antidiabética (24%), os valores médios no rastreamento foram de 10,1% para HbA1c e 238 mg / dL para FPG. Na linha de base, a HbA média1c foi de 10,2% e a média de FPG foi de 243 mg / dL. Comparado com o placebo, o tratamento com Actos titulado até uma dose final de 30 mg e 45 mg resultou em reduções da linha de base na HbA média1c de 2,3% e 2,6% e GPF média de 63 mg / dL e 95 mg / dL, respectivamente. Para pacientes que haviam sido tratados anteriormente com medicação antidiabética (76%), essa medicação foi descontinuada no rastreamento. Os valores médios na triagem foram de 9,4% para HbA1c e 216 mg / dL para FPG. Na linha de base, a HbA média1c foi de 10,7% e a média de FPG foi de 290 mg / dL. Comparado com o placebo, o tratamento com Actos titulado até uma dose final de 30 mg e 45 mg resultou em reduções da linha de base na HbA média1c 1,3% e 1,4% e FPG médio de 55 mg / dL e 60 mg / dL, respectivamente. Para muitos pacientes tratados anteriormente, a HbA1c e o FPG não havia retornado aos níveis de triagem até o final do estudo.
Em um estudo de 16 semanas, 197 pacientes com diabetes tipo 2 foram randomizados para tratamento com 30 mg de Actos ou placebo uma vez ao dia. A terapia com qualquer agente antidiabético anterior foi descontinuada 6 semanas antes do período duplo-cego. O tratamento com 30 mg de Actos produziu melhorias estatisticamente significativas na HbA1c e FPG no endpoint comparado ao placebo (Tabela 5).
Tabela 5 Parâmetros glicêmicos em um estudo controlado por placebo de 16 semanas
| Placebo | Actos 30 mg Uma vez por dia |
|
| População total HbA1c (%) |
N = 93 | N = 100 |
| Linha de base (média) | 10.3 | 10.5 |
| Alteração da linha de base (média ajustada+) | 0.8 | -0.6 |
| Diferença do placebo (média ajustada+) | -1.4* | |
| FPG (mg / dL) | N = 91 | N = 99 |
| Linha de base (média) | 270 | 273 |
| Alteração da linha de base (média ajustada+) | 8 | -50 |
| Diferença do placebo (média ajustada+) | -58* | |
|
+ Ajustado para linha de base, centro combinado e centro combinado pela interação do tratamento * p <0,050 vs. placebo |
Para os pacientes que não haviam sido tratados anteriormente com medicação antidiabética (40%), os valores médios no rastreamento foram 10,3% para HbA1c e 240 mg / dL para FPG. Na linha de base, a HbA média1c foi de 10,4% e a média de FPG foi de 254 mg / dL. Comparado com o placebo, o tratamento com Actos 30 mg resultou em reduções da linha de base na HbA média1c 1,0% e média de FPG de 62 mg / dL. Para pacientes que haviam sido tratados anteriormente com medicação antidiabética (60%), essa medicação foi descontinuada no rastreamento. Os valores médios na triagem foram de 9,4% para HbA1c e 216 mg / dL para FPG. Na linha de base, a HbA média1c foi de 10,6% e a média de FPG foi de 287 mg / dL. Comparado com o placebo, o tratamento com Actos 30 mg resultou em reduções da linha de base na HbA média1c 1,3% e FPG médio de 46 mg / dL. Para muitos pacientes tratados anteriormente, a HbA1c e o FPG não havia retornado aos níveis de triagem até o final do estudo.
Terapia combinada
Três estudos clínicos de 16 semanas, randomizados, duplo-cegos, controlados por placebo e três de 24 semanas, randomizados, duplo-cegos, controlados por dose estudos clínicos foram conduzidos para avaliar os efeitos do Actos no controle glicêmico em pacientes com diabetes tipo 2 que estavam inadequadamente controlado (HbA1c (8%) apesar da terapia atual com sulfonilureia, metformina ou insulina. O tratamento prévio do diabetes pode ter sido monoterapia ou terapia combinada.
Estudos Actos Plus Sulfonilureia
Dois estudos clínicos foram realizados com o Actos em combinação com uma sulfonilureia. Ambos os estudos incluíram pacientes com diabetes tipo 2 em uma sulfonilureia, isoladamente ou em combinação com outro agente antidiabético. Todos os outros agentes antidiabéticos foram retirados antes do início do tratamento do estudo. No primeiro estudo, 560 pacientes foram randomizados para receber 15 mg ou 30 mg de Actos ou placebo uma vez ao dia por 16 semanas, além do atual regime de sulfonilureia. Quando comparado ao placebo na semana 16, a adição de Actos à sulfonilureia reduziu significativamente a HbA média1c 0,9% e 1,3% e média de FPG em 39 mg / dL e 58 mg / dL nas doses de 15 mg e 30 mg, respectivamente.
No segundo estudo, 702 pacientes foram randomizados para receber 30 mg ou 45 mg de Actos uma vez ao dia por 24 semanas, além do atual regime de sulfonilureia. As reduções médias da linha de base na semana 24 na HbA1c 1,55% e 1,67% para as doses de 30 mg e 45 mg, respectivamente. As reduções médias da linha de base na FPG foram de 51,5 mg / dL e 56,1 mg / dL.
O efeito terapêutico de Actos em combinação com sulfonilureia foi observado em pacientes, independentemente de estarem recebendo doses baixa, média ou alta de sulfonilureia.
Estudos com metformina Actos Plus
Dois estudos clínicos foram conduzidos com Actos em combinação com metformina. Ambos os estudos incluíram pacientes com diabetes tipo 2 em uso de metformina, isoladamente ou em combinação com outro agente antidiabético. Todos os outros agentes antidiabéticos foram retirados antes do início do tratamento do estudo. No primeiro estudo, 328 pacientes foram randomizados para receber 30 mg de Actos ou placebo uma vez ao dia por 16 semanas, além do atual regime de metformina. Quando comparado ao placebo na semana 16, a adição de Actos à metformina reduziu significativamente a HbA média1c 0,8% e diminuiu o FPG médio em 38 mg / dL.
No segundo estudo, 827 pacientes foram randomizados para receber 30 mg ou 45 mg de Actos uma vez ao dia por 24 semanas, além do atual regime de metformina. As reduções médias da linha de base na semana 24 na HbA1c foram de 0,80% e 1,01% para as doses de 30 mg e 45 mg, respectivamente. As reduções médias da linha de base na FPG foram de 38,2 mg / dL e 50,7 mg / dL.
O efeito terapêutico de Actos em combinação com metformina foi observado em pacientes, independentemente de estarem recebendo doses mais baixas ou mais altas de metformina.
Estudos sobre insulina Actos Plus
Dois estudos clínicos foram conduzidos com Actos em combinação com insulina. Ambos os estudos incluíram pacientes com diabetes tipo 2 em insulina, isoladamente ou em combinação com outro agente antidiabético. Todos os outros agentes antidiabéticos foram retirados antes do início do tratamento do estudo. No primeiro estudo, 566 pacientes que receberam uma mediana de 60,5 unidades por dia de insulina foram randomizados para receber 15 mg ou 30 mg de Actos ou placebo uma vez por dia durante 16 semanas, além da insulina regime. Quando comparado ao placebo na semana 16, a adição de Actos à insulina reduziu significativamente a HbA1c 0,7% e 1,0% e FPG em 35 mg / dL e 49 mg / dL para a dose de 15 mg e 30 mg, respectivamente.
No segundo estudo, 690 pacientes que receberam uma mediana de 60,0 unidades por dia de insulina receberam 30 mg ou 45 mg de Actos uma vez ao dia por 24 semanas, além do regime atual de insulina. As reduções médias da linha de base na semana 24 na HbA1c foram 1,17% e 1,46% para as doses de 30 mg e 45 mg, respectivamente. As reduções médias da linha de base na FPG foram de 31,9 mg / dL e 45,8 mg / dL. O controle glicêmico aprimorado foi acompanhado por reduções médias em relação à linha de base nos requisitos de dose de insulina de 6,0% e 9,4% por dia para as doses de 30 mg e 45 mg, respectivamente.
O efeito terapêutico de Actos em combinação com insulina foi observado em pacientes, independentemente de estarem recebendo doses mais baixas ou mais altas de insulina.
topo
Indicações e uso
Actos é indicado como um complemento à dieta e exercício para melhorar o controle glicêmico em adultos com diabetes mellitus tipo 2.
topo
Contra-indicações
O início do Actos em pacientes com insuficiência cardíaca classe III ou IV estabelecida pela New York Heart Association (NYHA) é contra-indicado (consulte AVISO EM CAIXA).
Actos é contra-indicado em pacientes com hipersensibilidade conhecida a este produto ou a qualquer um de seus componentes.
topo
Advertências
Insuficiência Cardíaca e Outros Efeitos Cardíacos
Actos, como outras tiazolidinedionas, podem causar retenção de líquidos quando usados sozinhos ou em combinação com outros agentes antidiabéticos, incluindo insulina. A retenção de líquidos pode levar a ou agravar a insuficiência cardíaca. Os pacientes devem ser observados quanto a sinais e sintomas de insuficiência cardíaca. Se esses sinais e sintomas se desenvolverem, a insuficiência cardíaca deve ser gerenciada de acordo com os padrões atuais de atendimento. Além disso, deve ser considerada a descontinuação ou redução da dose de Actos (ver AVISO EM CAIXA). Os pacientes com status cardíaco de Classe III e IV da NYHA não foram estudados durante os ensaios clínicos pré-aprovados e o Actos não é recomendado nesses pacientes (ver AVISO EM CAIXA e CONTRA-INDICAÇÕES).
Em um ensaio clínico de 16 semanas, controlado por placebo, em dupla ocultação nos EUA, envolvendo 566 pacientes com tipo 2 diabetes, o Actos em doses de 15 mg e 30 mg em combinação com insulina foi comparado à terapia com insulina sozinho. Este estudo incluiu pacientes com diabetes de longa data e uma alta prevalência de condições médicas pré-existentes, como a seguir: hipertensão arterial (57,2%), neuropatia periférica (22,6%), doença coronariana (19,6%), retinopatia (13,1%), miocárdio infarto do miocárdio (8,8%), doença vascular (6,4%), angina de peito (4,4%), acidente vascular cerebral e / ou ataque isquêmico transitório (4,1%) e congestiva insuficiência cardíaca (2,3%).
Neste estudo, dois dos 191 pacientes que receberam 15 mg de Actos mais insulina (1,1%) e dois dos 188 pacientes que receberam 30 mg Actos mais insulina (1,1%) desenvolveram insuficiência cardíaca congestiva em comparação com nenhum dos 187 pacientes em uso de insulina. Todos esses quatro pacientes tinham histórico anterior de doenças cardiovasculares, incluindo doença arterial coronariana, procedimentos prévios de CRM e infarto do miocárdio. Em um estudo controlado por dose de 24 semanas, no qual o Actos foi co-administrado com insulina, 0,3% dos pacientes (1/345) em 30 mg e 0,9% (3/345) dos pacientes em 45 mg relataram ICC como um evento adverso grave .
A análise dos dados desses estudos não identificou fatores específicos que predizem maior risco de insuficiência cardíaca congestiva em terapia combinada com insulina.
No diabetes tipo 2 e insuficiência cardíaca congestiva (disfunção sistólica)
Um estudo de segurança pós-comercialização de 24 semanas foi realizado para comparar o Actos (n = 262) com a gliburida (n = 256) em pacientes diabéticos não controlados (média de HbA1c 8,8% na linha de base) com insuficiência cardíaca classe II e III da NYHA e fração de ejeção menor que 40% (FE média de 30% na linha de base). Ao longo do estudo, foi relatada hospitalização noturna por insuficiência cardíaca congestiva em 9,9% dos pacientes. pacientes em Actos em comparação com 4,7% dos pacientes em gliburida, com uma diferença de tratamento observada em 6 semanas. Este evento adverso associado ao Actos foi mais acentuado em pacientes em uso de insulina no início do estudo e em pacientes com mais de 64 anos de idade. Não foi observada diferença na mortalidade cardiovascular entre os grupos de tratamento.
O Actos deve ser iniciado com a dose mais baixa aprovada, se for prescrito para pacientes com diabetes tipo 2 e insuficiência cardíaca sistólica (NYHA Classe II). Se for necessário um aumento subsequente da dose, a dose deve ser aumentada gradualmente apenas após vários meses de tratamento com monitoramento cuidadoso para ganho de peso, edema ou sinais e sintomas de ICC exacerbação.
Estudo clínico prospectivo da pioglitazona em eventos macrovasculares (PROactive)
No PROactive, 5238 pacientes com diabetes tipo 2 e história prévia de doença macrovascular foram tratados com Actos (n = 2605), titulado à força até 45 mg uma vez ao dia ou placebo (n = 2633) (consulte REAÇÕES ADVERSAS). A porcentagem de pacientes que tiveram um evento de insuficiência cardíaca grave foi maior nos pacientes tratados com Actos (5,7%, n = 149) do que nos pacientes tratados com placebo (4,1%, n = 108). A incidência de morte subsequente a um relato de insuficiência cardíaca grave foi de 1,5% (n = 40) em pacientes tratados com Actos e de 1,4% (n = 37) em pacientes tratados com placebo. Nos pacientes tratados com um regime contendo insulina no início do estudo, a incidência de insuficiência cardíaca grave foi de 6,3% (n = 54/864) com Actos e 5,2% (n = 47/896) com placebo. Para os pacientes tratados com um regime contendo sulfonilureia no início do estudo, a incidência de insuficiência cardíaca grave foi de 5,8% (n = 94/1624) com Actos e de 4,4% (n = 71/1626) com placebo.
topo
Precauções
Geral
Actos exerce seu efeito anti-hiperglicêmico somente na presença de insulina. Portanto, Actos não deve ser utilizado em pacientes com diabetes tipo 1 ou no tratamento da cetoacidose diabética.
Hipoglicemia: os pacientes que recebem Actos em combinação com insulina ou agentes hipoglicêmicos orais podem estar em risco de hipoglicemia, e pode ser necessária uma redução na dose do agente concomitante.
Cardiovascular: Em ensaios clínicos controlados por placebo nos EUA que excluíram pacientes com status cardíaco de Classe III e IV da New York Heart Association (NYHA), a incidência de eventos adversos cardíacos graves relacionados à expansão de volume não aumentaram em pacientes tratados com Actos em monoterapia ou em combinação com sulfonilureias ou metformina vs. pacientes tratados com placebo. Nos estudos combinados de insulina, um pequeno número de pacientes com histórico de doenças doença cardíaca desenvolveu insuficiência cardíaca congestiva quando tratado com Actos em combinação com insulina (Vejo ADVERTÊNCIAS). Os pacientes com status cardíaco da Classe III e IV da NYHA não foram estudados nesses ensaios clínicos do Actos. Actos não está indicado em pacientes com status cardíaco NYHA Classe III ou IV.
Na experiência pós-comercialização com Actos, foram relatados casos de insuficiência cardíaca congestiva em pacientes com e sem doença cardíaca previamente conhecida.
Edema: Actos deve ser usado com cautela em pacientes com edema. Em todos os ensaios clínicos nos EUA, o edema foi relatado com mais frequência em pacientes tratados com Actos do que em pacientes tratados com placebo e parece estar relacionado à dose (consulte REAÇÕES ADVERSAS). Na experiência pós-comercialização, foram recebidos relatos de início ou agravamento do edema. Como as tiazolidinedionas, incluindo Actos, podem causar retenção de líquidos, o que pode exacerbar ou levar à insuficiência cardíaca congestiva, o Actos deve ser usado com cautela em pacientes com risco de insuficiência cardíaca. Os pacientes devem ser monitorados quanto a sinais e sintomas de insuficiência cardíaca (ver AVISO EM CAIXA, ADVERTÊNCIASe PRECAUÇÕES).
Ganho de peso: O ganho de peso relacionado à dose foi observado apenas com o Actos e em combinação com outros agentes hipoglicêmicos (Tabela 6). O mecanismo de ganho de peso não é claro, mas provavelmente envolve uma combinação de retenção de líquidos e acúmulo de gordura.
Tabela 6 Alterações de peso (kg) da linha de base durante os ensaios clínicos de dupla ocultação com Actos
| Grupo de controle (Placebo) |
Actos 15 mg |
Actos 30 mg |
Actos 45 mg |
||
| Mediana (25º/75º percentil) |
Mediana (25º/75º percentil) |
Mediana (25º/75º percentil) |
Mediana (25º/75º percentil) |
||
| Monoterapia | -1.4 (-2.7/0.0) n = 256 |
0.9(-0.5/3.4) n = 79 |
1.0(-0.9/3.4) n = 188 |
2.6 (0.2/5.4) n = 79 |
|
| Terapia combinada | Sulfonilureia | -0.5 (-1.8/0.7) n = 187 |
2.0 (0.2/3.2) n = 183 |
3.1 (1.1/5.4) n = 528 |
4.1 (1.8/7.3) n = 333 |
| Metformina | -1.4 (-3.2/0.3) n = 160 |
N / D | 0.9(-0.3/3.2) n = 567 |
1.8(-0.9/5.0) n = 407 |
|
| Insulina | 0.2 (-1.4/1.4) n = 182 |
2.3 (0.5/4.3) n = 190 |
3.3 (0.9/6.3) n = 522 |
4.1 (1.4/6.8) n = 338 |
|
| Nota: Durações de teste de 16 a 26 semanas |
Ovulação: A terapia com Actos, como outras tiazolidinedionas, pode resultar em ovulação em algumas mulheres anovulatórias na pré-menopausa. Como resultado, esses pacientes podem estar em maior risco de gravidez enquanto tomam o Actos. Portanto, contracepção adequada em mulheres na pré-menopausa deve ser recomendada. Esse possível efeito não foi investigado em estudos clínicos, portanto a frequência dessa ocorrência não é conhecida.
Hematológico: Actos pode causar reduções na hemoglobina e no hematócrito. Em todos os estudos clínicos, os valores médios de hemoglobina caíram de 2% a 4% nos pacientes tratados com Actos. Essas alterações ocorreram principalmente nas primeiras 4 a 12 semanas de terapia e permaneceram relativamente constantes depois disso. Essas alterações podem estar relacionadas ao aumento do volume plasmático e raramente foram associadas a efeitos clínicos hematológicos significativos (consulte REAÇÕES ADVERSASAnormalidades laboratoriais).
Efeitos hepáticos: Em estudos clínicos de pré-aprovação em todo o mundo, mais de 4500 indivíduos foram tratados com Actos. Nos estudos clínicos dos EUA, mais de 4700 pacientes com diabetes tipo 2 receberam Actos. Não houve evidência de hepatotoxicidade induzida por drogas ou elevação dos níveis de ALT nos estudos clínicos.
Durante os ensaios clínicos pré-aprovados controlados por placebo nos EUA, um total de 4 de 1526 (0,26%) pacientes tratados com Actos e 2 de 793 (0,25%) pacientes tratados com placebo apresentaram valores de ALT ≥ 3 vezes o limite superior de normal. As elevações da ALT nos pacientes tratados com Actos foram reversíveis e não estavam claramente relacionadas à terapia com Actos.
Na experiência pós-comercialização com o Actos, foram recebidos relatos de hepatites e elevações de enzimas hepáticas a 3 ou mais vezes o limite superior do normal. Muito raramente, esses relatos envolveram insuficiência hepática com e sem resultado fatal, embora a causalidade não tenha sido estabelecida.
Na pendência da disponibilidade dos resultados de grandes ensaios clínicos controlados a longo prazo e adicionais dados de segurança pós-comercialização, recomenda-se que os pacientes tratados com Actos sejam monitorados periodicamente enzimas.
Os níveis séricos de ALT (alanina aminotransferase) devem ser avaliados antes do início da terapia com Atos em todos os pacientes e, posteriormente, periodicamente, de acordo com o julgamento clínico do serviço de saúde profissional. Os testes de função hepática também devem ser obtidos para os pacientes se ocorrerem sintomas sugestivos de disfunção hepática, por exemplo, náusea, vômito, dor abdominal, fadiga, anorexia ou urina escura. A decisão de continuar o paciente em terapia com Actos deve ser orientada por julgamento clínico, pendente de avaliações laboratoriais. Se houver icterícia, a terapia medicamentosa deve ser descontinuada.
A terapia com Actos não deve ser iniciada se o paciente apresentar evidência clínica de doença hepática ativa ou se os níveis de ALT excederem 2,5 vezes o limite superior do normal. Pacientes com enzimas hepáticas levemente elevadas (níveis de ALT de 1 a 2,5 vezes o limite superior do normal) a linha de base ou a qualquer momento durante a terapia com Actos deve ser avaliada para determinar a causa da enzima hepática elevação. O início ou continuação da terapia com Actos em pacientes com enzimas hepáticas levemente elevadas deve prosseguir com cautela e inclua acompanhamento clínico adequado, que pode incluir enzimas hepáticas mais frequentes monitoramento. Se os níveis séricos de transaminase estiverem aumentados (ALT> 2,5 vezes o limite superior do normal), o fígado testes de função devem ser avaliados com mais freqüência até que os níveis retornem ao normal ou ao pré-tratamento valores. Se os níveis de ALT excederem três vezes o limite superior do normal, o teste deve ser repetido o mais rápido possível. Se os níveis de ALT permanecerem> 3 vezes o limite superior do normal ou se o paciente estiver com icterícia, a terapia com Actos deve ser descontinuada.
Edema macular: Foi relatado edema macular na experiência pós-comercialização em pacientes diabéticos que estavam tomando pioglitazona ou outra tiazolidinediona. Alguns pacientes apresentaram visão turva ou diminuição da acuidade visual, mas alguns pacientes parecem ter sido diagnosticados no exame oftalmológico de rotina. Alguns pacientes apresentaram edema periférico no momento do diagnóstico de edema macular. Alguns pacientes apresentaram melhora no edema macular após a descontinuação da tiazolidinediona. Não se sabe se existe ou não uma relação causal entre pioglitazona e edema macular. Pacientes com diabetes devem fazer exames oftalmológicos regulares por um oftalmologista, de acordo com os padrões de atendimento da American Diabetes Association. Além disso, qualquer diabético que relatar qualquer tipo de sintoma visual deve ser imediatamente encaminhado a um oftalmologista, independentemente dos medicamentos subjacentes do paciente ou de outros achados físicos (consulte REAÇÕES ADVERSAS).
Fraturas: em um estudo randomizado (PROactive) em pacientes com diabetes tipo 2 (duração média de diabetes 9,5 anos), foi observada uma incidência aumentada de fratura óssea em pacientes do sexo feminino pioglitazona. Durante um seguimento médio de 34,5 meses, a incidência de fratura óssea em mulheres foi de 5,1% (44/870) para pioglitazona versus 2,5% (23/905) para placebo. Essa diferença foi observada após o primeiro ano de tratamento e permaneceu durante o curso do estudo. A maioria das fraturas observadas em pacientes do sexo feminino eram fraturas não vertebrais, incluindo membros inferiores e membros superiores distais. Não foi observado aumento nas taxas de fratura em homens tratados com pioglitazona 1,7% (30/1735) versus placebo 2,1% (37/1728). O risco de fratura deve ser considerado no atendimento de pacientes, principalmente do sexo feminino, tratados com pioglitazona e atenção deve ser dada à avaliação e manutenção da saúde óssea de acordo com os padrões atuais de cuidados.
Resultados Macrovasculares: Não houve estudos clínicos estabelecendo evidências conclusivas de redução de risco macrovascular com Actos ou qualquer outro medicamento antidiabético.
Testes laboratoriais
FPG e HbA1c as medições devem ser realizadas periodicamente para monitorar o controle glicêmico e a resposta terapêutica ao Actos.
O monitoramento das enzimas hepáticas é recomendado antes do início da terapia com Actos em todos os pacientes e, posteriormente, periodicamente, de acordo com o julgamento clínico do profissional de saúde (consulte PRECAUÇÕES, Efeitos Hepáticos e Gerais REAÇÕES ADVERSAS, Níveis séricos de transaminase).
Informação para Pacientes
É importante instruir os pacientes a seguir as instruções da dieta e fazer testes regulares de glicose no sangue e hemoglobina glicosilada. Durante períodos de estresse, como febre, trauma, infecção ou cirurgia, os requisitos de medicação podem mudar e os pacientes devem ser lembrados a procurar aconselhamento médico imediatamente.
Pacientes que experimentam um aumento invulgarmente rápido de peso ou edema ou que desenvolvem falta de ar ou outros sintomas de insuficiência cardíaca enquanto estiver a tomar o Actos, deve comunicar imediatamente estes sintomas aos seus médico.
Os pacientes devem ser informados de que os exames de sangue para a função hepática serão realizados antes do início da terapia e, posteriormente, periodicamente, de acordo com o julgamento clínico do profissional de saúde. Os pacientes devem ser orientados a procurar aconselhamento médico imediato para náusea, vômito, dor abdominal, fadiga, anorexia ou urina escura inexplicada.
Os pacientes devem ser instruídos a tomar Actos uma vez ao dia. Actos pode ser tomado com ou sem refeições. Se uma dose é esquecida em um dia, a dose não deve ser dobrada no dia seguinte.
Ao usar terapia combinada com insulina ou agentes hipoglicêmicos orais, os riscos de hipoglicemia, seus sintomas e tratamento e condições que predispõem ao seu desenvolvimento devem ser explicadas aos pacientes e seus familiares membros.
A terapia com Actos, como outras tiazolidinedionas, pode resultar em ovulação em algumas mulheres anovulatórias na pré-menopausa. Como resultado, esses pacientes podem estar em maior risco de gravidez enquanto tomam o Actos. Portanto, contracepção adequada em mulheres na pré-menopausa deve ser recomendada. Esse possível efeito não foi investigado em estudos clínicos, portanto a frequência dessa ocorrência não é conhecida.
Interações medicamentosas
Estudos de interação medicamentosa in vivo sugeriram que a pioglitazona pode ser um indutor fraco do substrato da isoforma 3A4 do CYP 450 (consulte FARMACOLOGIA CLÍNICA, Metabolismo e Interações medicamentosas).
Um inibidor enzimático do CYP2C8 (como o gemfibrozil) pode aumentar significativamente a AUC de pioglitazona e um indutor enzimático do CYP2C8 (como a rifampicina) podem diminuir significativamente a AUC de pioglitazona. Portanto, se um inibidor ou indutor do CYP2C8 for iniciado ou interrompido durante o tratamento com pioglitazona, poderão ser necessárias alterações no tratamento do diabetes com base na resposta clínica (consulte FARMACOLOGIA CLÍNICA, Interações medicamentosas).
Carcinogênese, mutagênese, comprometimento da fertilidade
Foi realizado um estudo de carcinogenicidade de dois anos em ratos machos e fêmeas em doses orais até 63 mg / kg (aproximadamente 14 vezes a dose oral humana máxima recomendada de 45 mg, com base em mg / m2). Tumores induzidos por drogas não foram observados em nenhum órgão, exceto na bexiga urinária. Foram observadas neoplasias de células de transição benignas e / ou malignas em ratos machos a 4 mg / kg / dia e acima (aproximadamente igual à dose oral humana máxima recomendada com base em mg / m2). Foi realizado um estudo de carcinogenicidade de dois anos em camundongos machos e fêmeas em doses orais de até 100 mg / kg / dia (aproximadamente 11 vezes a dose oral humana máxima recomendada com base em mg / m2). Não foram observados tumores induzidos por drogas em nenhum órgão.
Durante a avaliação prospectiva da citologia urinária envolvendo mais de 1800 pacientes recebendo Actos em ensaios clínicos com duração de até um ano, não foram identificados novos casos de tumores da bexiga. Em dois estudos de três anos em que a pioglitazona foi comparada ao placebo ou à gliburida, houve 16/3656 (0,44%) relatos de câncer de bexiga em pacientes que tomam pioglitazona em comparação com 5/3679 (0,14%) em pacientes que não tomam pioglitazona. Após excluir os pacientes em que a exposição ao medicamento em estudo era inferior a um ano no momento do diagnóstico de câncer de bexiga, houve seis (0,16%) casos em pioglitazona e dois (0,05%) em placebo.
O pioglitazona HCl não foi mutagênico em uma série de estudos de toxicologia genética, incluindo o ensaio bacteriano Ames, um gene avançado de células de mamíferos ensaio de mutação (CHO / HPRT e AS52 / XPRT), um ensaio citogenético in vitro usando células CHL, um ensaio não programado de síntese de DNA e um micronúcleo in vivo ensaio.
Não foram observados efeitos adversos na fertilidade em ratos machos e fêmeas em doses orais até 40 mg / kg de pioglitazona HCl diariamente antes e durante o acasalamento e a gestação (aproximadamente 9 vezes a dose oral humana máxima recomendada, com base em mg / m2).
Toxicologia Animal
Foi observado aumento do coração em camundongos (100 mg / kg), ratos (4 mg / kg e acima) e cães (3 mg / kg) tratados por via oral com pioglitazona HCl (aproximadamente 11, 1 e 2 vezes a dose oral humana máxima recomendada para camundongos, ratos e cães, respectivamente, com base em mg / m2). Em um estudo de um ano em ratos, a morte precoce relacionada a medicamentos devido a aparente disfunção cardíaca ocorreu dose oral de 160 mg / kg / dia (aproximadamente 35 vezes a dose oral humana máxima recomendada, com base em mg / m2). O aumento do coração foi observado em um estudo de 13 semanas em macacos com doses orais de 8,9 mg / kg e acima (aproximadamente 4 vezes a dose oral humana máxima recomendada com base em mg / m2), mas não em um estudo de 52 semanas com doses orais de até 32 mg / kg (aproximadamente 13 vezes a dose oral humana máxima recomendada, com base em mg / m2).
Gravidez
Categoria C. da gravidez A pioglitazona não era teratogênica em ratos com doses orais até 80 mg / kg ou em coelhos administrados até 160 mg / kg durante a organogênese (aproximadamente 17 e 40 vezes a dose oral máxima recomendada em humanos em mg / m2, respectivamente). Atraso no parto e embriotoxicidade (como evidenciado pelo aumento das perdas pós-implantação, atraso no desenvolvimento e redução do peso fetal) foram observados em ratos com doses orais de 40 mg / kg / dia e acima (aproximadamente 10 vezes a dose oral humana máxima recomendada, com base na mg / m2). Não foi observada toxicidade funcional ou comportamental na prole de ratos. Em coelhos, foi observada embriotoxicidade em uma dose oral de 160 mg / kg (aproximadamente 40 vezes a dose oral máxima recomendada em humanos, com base em mg / m2). Foi observado atraso no desenvolvimento pós-natal, atribuído à diminuição do peso corporal, na prole de ratos com doses orais de 10 mg / kg e acima durante os períodos tardios da gestação e lactação (aproximadamente 2 vezes a dose oral humana máxima recomendada, com base em mg / m2).
Não existem estudos adequados e bem controlados em mulheres grávidas. O Actos deve ser utilizado durante a gravidez apenas se o benefício potencial justificar o risco potencial para o feto.
Como as informações atuais sugerem fortemente que níveis anormais de glicose no sangue durante a gravidez estão associados a uma maior incidência de anomalias congênitas, também Como aumento da morbimortalidade neonatal, a maioria dos especialistas recomenda que a insulina seja usada durante a gravidez para manter os níveis de glicose no sangue o mais próximo possível do normal. possível.
Mães que amamentam
A pioglitazona é secretada no leite de ratos lactantes. Não se sabe se Actos é secretado no leite humano. Como muitos medicamentos são excretados no leite humano, o Actos não deve ser administrado a mulheres que amamentam.
Uso pediátrico
A segurança e a eficácia do Actos em pacientes pediátricos não foram estabelecidas.
Uso de idosos
Aproximadamente 500 pacientes em ensaios clínicos controlados por placebo de Actos tinham 65 anos ou mais. Não foram observadas diferenças significativas em eficácia e segurança entre esses pacientes e pacientes mais jovens.
topo
Reações adversas
Mais de 8500 pacientes com diabetes tipo 2 foram tratados com Actos em ensaios clínicos randomizados, duplo-cegos e controlados. Isso inclui 2605 pacientes de alto risco com diabetes tipo 2 tratados com Actos no ensaio clínico PROactive. Mais de 6000 pacientes foram tratados por 6 meses ou mais e mais de 4500 pacientes por um ano ou mais. Mais de 3000 pacientes receberam Actos por pelo menos 2 anos.
A incidência geral e os tipos de eventos adversos relatados em ensaios clínicos controlados com placebo da Actos em monoterapia com doses de 7,5 mg, 15 mg, 30 mg ou 45 mg uma vez ao dia são mostrados na Tabela 7.
Tabela 7 Estudos clínicos controlados por placebo de Actos em monoterapia: eventos adversos relatados com frequência ≥ 5% dos pacientes tratados com Actos
| (% de pacientes) | ||
| Placebo N = 259 |
Actos N = 606 |
|
| Infecção do trato respiratório superior | 8.5 | 13.2 |
| Dor de cabeça | 6.9 | 9.1 |
| Sinusite | 4.6 | 6.3 |
| Mialgia | 2.7 | 5.4 |
| Desordem Dentária | 2.3 | 5.3 |
| Diabetes Mellitus Agravado | 8.1 | 5.1 |
| Faringite | 0.8 | 5.1 |
Para a maioria dos eventos adversos clínicos, a incidência foi semelhante nos grupos tratados com Actos em monoterapia e naqueles tratados em combinação com sulfonilureias, metformina e insulina. Houve um aumento na ocorrência de edema nos pacientes tratados com Actos e insulina em comparação à insulina isoladamente.
Num ensaio Actos mais insulina, controlado por placebo, com duração de 16 semanas (n = 379), 10 doentes tratados com Actos plus a insulina desenvolveu dispnéia e também, em algum momento da terapia, desenvolveu mudança de peso ou edema. Sete desses 10 pacientes receberam diuréticos para tratar esses sintomas. Isso não foi relatado no grupo insulina mais placebo.
A incidência de desistências de ensaios clínicos controlados por placebo devido a um evento adverso diferente da hiperglicemia foi semelhante nos pacientes tratados com placebo (2,8%) ou Actos (3,3%).
Em estudos de terapia combinada controlada com sulfonilureia ou insulina, foi relatada hipoglicemia leve a moderada, que parece estar relacionada à dose (ver PRECAUÇÕES, Geral, Hipoglicemia e Dosagem e Administração, Terapia combinada).
Em estudos duplo-cegos dos EUA, foi relatada anemia em <2% dos pacientes tratados com Actos mais sulfonilureia, metformina ou insulina (ver PRECAUÇÕESGeral, Hematológico).
Em estudos em monoterapia, o edema foi relatado para 4,8% (com doses de 7,5 mg a 45 mg) dos pacientes tratados com Actos versus 1,2% dos pacientes tratados com placebo. Em estudos de terapia combinada, foi relatado edema em 7,2% dos pacientes tratados com Actos e sulfonilureias, em comparação com 2,1% dos pacientes tratados apenas com sulfonilureias. Nos estudos de terapia combinada com metformina, foi relatado edema em 6,0% dos pacientes em terapia combinada, em comparação com 2,5% dos pacientes em uso de metformina isoladamente. Em estudos de terapia combinada com insulina, foi relatado edema em 15,3% dos pacientes em terapia combinada, em comparação com 7,0% dos pacientes em uso isolado de insulina. A maioria desses eventos foi considerada de intensidade leve ou moderada (ver PRECAUÇÕES, Geral, Edema).
Em um ensaio clínico de 16 semanas de terapia combinada com insulina e Actos, mais pacientes desenvolveram insuficiência cardíaca congestiva na terapia combinada (1,1%) em comparação a nenhum apenas com insulina (ver ADVERTÊNCIAS, Insuficiência Cardíaca e Outros Efeitos Cardíacos).
Estudo clínico prospectivo da pioglitazona em eventos macrovasculares (PROactive)
No PROactive, 5238 pacientes com diabetes tipo 2 e história prévia de doença macrovascular foram tratados com Actos (n = 2605), titulados à força até 45 mg por dia ou placebo (n = 2633), além do padrão de cuidados. Quase todos os indivíduos (95%) estavam recebendo medicamentos cardiovasculares (betabloqueadores, inibidores da ECA, BRA, bloqueadores dos canais de cálcio, nitratos, diuréticos, aspirina, estatinas, fibratos). Os pacientes tinham idade média de 61,8 anos, duração média de diabetes 9,5 anos e HbA1c 8,1%. A duração média do acompanhamento foi de 34,5 meses. O objetivo principal deste estudo foi examinar o efeito do Actos na mortalidade e morbidade macrovascular em pacientes com diabetes mellitus tipo 2 que apresentavam alto risco de eventos macrovasculares. A variável de eficácia primária foi o tempo para a primeira ocorrência de qualquer evento no endpoint composto cardiovascular (ver tabela 8 abaixo). Embora não tenha havido diferença estatisticamente significante entre Actos e placebo na incidência de três anos de Em um primeiro evento nesse composto, não houve aumento na mortalidade ou no total de eventos macrovasculares com Actos.
Tabela 8 Número de eventos primeiro e total para cada componente no endpoint composto cardiovascular
| Placebo N = 2633 |
Actos N = 2605 |
|||
| Eventos cardiovasculares | Primeiros Eventos (N) |
Total de eventos (N) |
Primeiros Eventos (N) |
Total de eventos (N) |
| Qualquer evento | 572 | 900 | 514 | 803 |
| Mortalidade por todas as causas | 122 | 186 | 110 | 177 |
| MI não fatal | 118 | 157 | 105 | 131 |
| Acidente vascular encefálico | 96 | 119 | 76 | 92 |
| ACS | 63 | 78 | 42 | 65 |
| Intervenção cardíaca | 101 | 240 | 101 | 195 |
| Amputação das pernas principais | 15 | 28 | 9 | 28 |
| Revascularização das pernas | 57 | 92 | 71 | 115 |
Também foram recebidos relatórios pós-comercialização de novo edema macular diabético com piora e diminuição da acuidade visual (consulte PRECAUÇÕES, Geral, Edema Macular).
Anormalidades laboratoriais
Hematológico: Actos pode causar reduções na hemoglobina e no hematócrito. A queda de hemoglobina e hematócrito com Actos parece estar relacionada à dose. Em todos os estudos clínicos, os valores médios de hemoglobina caíram de 2% a 4% nos pacientes tratados com Actos. Essas alterações geralmente ocorreram nas primeiras 4 a 12 semanas de terapia e permaneceram relativamente estáveis a partir de então. Essas alterações podem estar relacionadas ao aumento do volume plasmático associado à terapia com Actos e raramente foram associadas a efeitos clínicos hematológicos significativos.
Níveis de transaminase sérica: durante todos os estudos clínicos nos EUA, 14 de 4780 (0,30%) pacientes tratados com Actos apresentaram valores de ALT <3 vezes o limite superior do normal durante o tratamento. Todos os pacientes com valores de acompanhamento apresentaram elevações reversíveis na ALT. Na população de pacientes tratados com Actos, os valores médios de bilirrubina, AST, ALT, fosfatase alcalina e GGT diminuíram na visita final em comparação com a linha de base. Menos de 0,9% dos pacientes tratados com Actos foram retirados de ensaios clínicos nos EUA devido a testes de função hepática anormais.
Nos ensaios clínicos de pré-aprovação, não houve casos de reações medicamentosas idiossincráticas que levassem à insuficiência hepática (ver PRECAUÇÕES, Efeitos Hepáticos Gerais).
Níveis de CPK: Durante os testes laboratoriais necessários em ensaios clínicos, foram observadas elevações esporádicas e transitórias nos níveis de creatina fosfoquinase (CPK). Uma elevação isolada acima de 10 vezes o limite superior do normal foi observada em 9 pacientes (valores de 2150 a 11400 UI / L). Seis desses pacientes continuaram recebendo Actos, dois pacientes haviam completado o recebimento do estudo medicação no momento do valor elevado e um paciente interrompeu a medicação em estudo devido à elevação. Essas elevações foram resolvidas sem sequelas clínicas aparentes. A relação desses eventos com a terapia Actos é desconhecida.
topo
Overdose
Durante os ensaios clínicos controlados, foi relatado um caso de sobredosagem com Actos. Um paciente do sexo masculino tomou 120 mg por dia durante quatro dias, depois 180 mg por dia durante sete dias. O paciente negou qualquer sintoma clínico durante esse período.
Em caso de sobredosagem, o tratamento de suporte apropriado deve ser iniciado de acordo com os sinais e sintomas clínicos do paciente.
topo
Dosagem e Administração
Actos deve ser tomado uma vez ao dia, independentemente das refeições.
O manejo da terapia antidiabética deve ser individualizado. Idealmente, a resposta à terapia deve ser avaliada usando HbA1c que é um indicador melhor do controle glicêmico a longo prazo do que o FPG sozinho. HbA1c reflete glicemia nos últimos dois a três meses. Em uso clínico, recomenda-se que os pacientes sejam tratados com Actos por um período de tempo adequado para avaliar a alteração na HbA1c (três meses), a menos que o controle glicêmico se deteriore. Após o início do Actos ou com aumento da dose, os pacientes devem ser cuidadosamente monitorados quanto a eventos adversos relacionados à retenção de líquidos (ver AVISO EM CAIXA e ADVERTÊNCIAS).
Monoterapia
Actos em monoterapia em pacientes não adequadamente controlados com dieta e exercício pode ser iniciado com 15 mg ou 30 mg uma vez ao dia. Para pacientes que respondem inadequadamente à dose inicial de Actos, a dose pode ser aumentada em incrementos de até 45 mg uma vez ao dia. Para pacientes que não respondem adequadamente à monoterapia, a terapia combinada deve ser considerada.
Terapia combinada
Sulfonilureias: Actos em combinação com uma sulfonilureia pode ser iniciado com 15 mg ou 30 mg uma vez ao dia. A dose atual de sulfonilureia pode ser continuada após o início da terapia com Actos. Se os pacientes reportarem hipoglicemia, a dose da sulfonilureia deve ser diminuída.
Metformina: Actos em combinação com metformina pode ser iniciado com 15 mg ou 30 mg uma vez ao dia. A dose atual de metformina pode ser continuada após o início da terapia com Actos. É improvável que a dose de metformina exija um ajuste devido à hipoglicemia durante a terapia combinada com Actos.
Insulina: Actos em combinação com insulina pode ser iniciado com 15 mg ou 30 mg uma vez ao dia. A dose atual de insulina pode ser continuada após o início da terapia com Actos. Nos pacientes que recebem Actos e insulina, a dose de insulina pode ser reduzida de 10% a 25% se o paciente relatar hipoglicemia ou se as concentrações plasmáticas de glicose diminuírem para menos de 100 mg / dL. Ajustes adicionais devem ser individualizados com base na resposta de redução da glicose.
Dose máxima recomendada
A dose de Actos não deve exceder 45 mg uma vez ao dia em monoterapia ou em combinação com sulfonilureia, metformina ou insulina.
Não é recomendado o ajuste da dose em doentes com insuficiência renal (ver FARMACOLOGIA CLÍNICA, Pharmacokinetics and Drug Metabolism).
A terapêutica com Actos não deve ser iniciada se o paciente apresentar evidência clínica de doença hepática ativa ou aumento dos níveis séricos de transaminase (ALT maior que 2,5 vezes o limite superior do normal) no início do tratamento (Vejo PRECAUÇÕES, Efeitos Hepáticos e Gerais FARMACOLOGIA CLÍNICA, Populações Especiais, Insuficiência Hepática). Recomenda-se o monitoramento de enzimas hepáticas em todos os pacientes antes do início da terapia com Actos e, posteriormente, periodicamente (ver PRECAUÇÕES, Efeitos Hepáticos Gerais).
Não há dados sobre o uso do Actos em pacientes com menos de 18 anos de idade; portanto, o uso de Actos em pacientes pediátricos não é recomendado.
Não há dados disponíveis sobre o uso de Actos em combinação com outra tiazolidinediona.
topo
Como fornecido
Actos está disponível em comprimidos de 15 mg, 30 mg e 45 mg, da seguinte forma:
Comprimido de 15 mg: comprimido branco a esbranquiçado, redondo, convexo, não marcado com "Actos" numa das faces e "15" na outra, disponível em:
NDC 64764-151-04 Garrafas de 30
NDC 64764-151-05 Garrafas de 90
NDC 64764-151-06 Garrafas de 500
Comprimido de 30 mg: comprimido branco a esbranquiçado, redondo, achatado e não marcado com "Actos" numa das faces e "30" na outra, disponível em:
NDC 64764-301-14 Garrafas de 30
NDC 64764-301-15 Garrafas de 90
NDC 64764-301-16 Garrafas de 500
Comprimido de 45 mg: comprimido branco a esbranquiçado, redondo, achatado e não marcado com "Actos" numa das faces e "45" na outra, disponível em:
NDC 64764-451-24 Garrafas de 30
NDC 64764-451-25 Garrafas de 90
NDC 64764-451-26 Garrafas de 500
ARMAZENAMENTO
Armazenar a 25 ° C (77 ° F); excursões permitidas a 15-30 ° C (59-86 ° F) [consulte Temperatura ambiente controlada pela USP]. Manter o recipiente bem fechado e proteger da umidade e umidade.
topo
Referências
- Deng, LJ, et al. Efeito do gemfibrozil na farmacocinética da pioglitazona. Eur J Clin Pharmacol 2005; 61: 831-836, Tabela 1.
2. Jaakkola, T. et ai. Efeito da rifampicina na farmacocinética da pioglitazona. Clin Pharmacol Brit Jour 2006; 61:1 70-78.
Apenas Rx
Fabricado por:
Takeda Pharmaceutical Company Limited
Osaka, Japão
Comercializado por:
Takeda Pharmaceuticals America, Inc.
One Takeda Parkway
Deerfield, IL 60015
Actos® é uma marca registrada da Takeda Pharmaceutical Company Limited e usada sob licença pela Takeda Pharmaceuticals America, Inc.
Todos os outros nomes de marcas comerciais são de propriedade de seus respectivos proprietários.
Última atualização: 08/09
Actos, pioglitazona hcl, informações para o paciente (Em inglês simples)
Informações detalhadas sobre sinais, sintomas, causas, tratamentos da diabetes
As informações desta monografia não se destinam a cobrir todos os usos possíveis, instruções, precauções, interações medicamentosas ou efeitos adversos. Esta informação é generalizada e não se destina a aconselhamento médico específico. Se você tiver dúvidas sobre os medicamentos que está tomando ou deseja obter mais informações, consulte seu médico, farmacêutico ou enfermeiro.
de volta a: Procurar todos os medicamentos para diabetes



