Exubera para tratamento de diabetes
Marca: Exubera
Nome genérico: insulina humana
Forma de dosagem: pó de inalação
Conteúdo:
Descrição
Farmacologia Clínica
Estudos clínicos
Indicações e uso
Contra-indicações
Advertências
Precauções
Interações medicamentosas
Reações adversas
Sobredosagem
Dosagem e Administração
Como fornecido
Exubera, insulina humana [origem do rDNA] Informações do paciente (Em inglês simples)
Descrição
Exubera® consiste em blisters contendo pó de inalação de insulina humana, que são administrados com o Exubera® Inalador. As bolhas Exubera contêm insulina humana produzida por tecnologia de DNA recombinante utilizando uma cepa de laboratório não patogênica de Escherichia coli (K12). Quimicamente, a insulina humana tem a fórmula empírica C257H383N65O77S6 e um peso molecular de 5808. A insulina humana tem a seguinte sequência de aminoácidos primária:
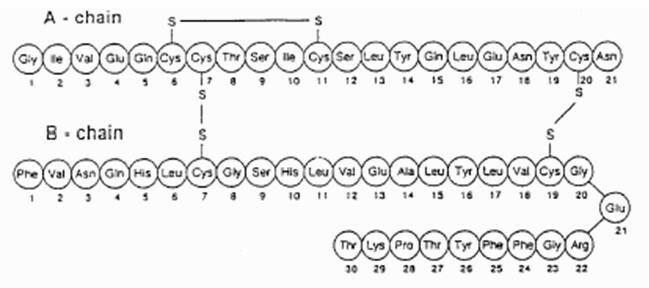
Exubera (insulina humana [origem do rDNA]) O pó para inalação é um pó branco a esbranquiçado em um blister de dose unitária (massa de enchimento, consulte a Tabela 1). Cada blister de dose unitária de Exubera contém uma dose de 1 mg ou 3 mg de insulina (ver Tabela 1) formulação em pó homogênea contendo citrato de sódio (di-hidrato), manitol, glicina e sódio hidróxido. Depois que um blister Exubera é inserido no inalador, o paciente bombeia a alça do inalador e pressiona um botão, fazendo com que o blister seja perfurado. O pó de inalação de insulina é então disperso na câmara, permitindo ao paciente inalar o pó em aerossol.
Sob condições padronizadas de teste in vitro, o Exubera fornece uma dose específica de insulina emitida pelo bocal do inalador (consulte a Tabela 1). Uma fração da massa total de partículas é emitida como partículas finas capazes de atingir o pulmão profundo. Até 45% do conteúdo do blister de 1 mg e até 25% do conteúdo do blister de 3 mg, podem ser retidos no blister.
Tabela 1: Nomenclatura e informações sobre doses
| Massa de preenchimento (mg de pó) |
Dose nominal (mg de insulina) |
Dose emitida*,†(mg de insulina) |
Dose fina de partículasc,†(mg de insulina) |
|---|---|---|---|
| |||
| 1.7 | 1.0 | 0.53 | 0.4 |
| 5.1 | 3.0 | 2.03 | 1.0 |
A quantidade real de insulina entregue ao pulmão dependerá de fatores individuais do paciente, como o perfil do fluxo inspiratório. In vitro, as métricas de aerossol emitidas não são afetadas a taxas de fluxo acima de 10 L / min.
topo
Farmacologia Clínica
Mecanismo de ação
A atividade primária da insulina é a regulação do metabolismo da glicose. A insulina reduz as concentrações de glicose no sangue, estimulando a captação periférica de glicose pelo músculo esquelético e pela gordura e inibindo a produção hepática de glicose. A insulina inibe a lipólise no adipócito, inibe a proteólise e melhora a síntese de proteínas.
Farmacocinética
Absorção
Exubera fornece insulina por inalação oral. A insulina é absorvida tão rapidamente quanto os análogos de insulina de ação rápida administrados por via subcutânea e mais rapidamente do que insulina humana regular administrada por via subcutânea em indivíduos saudáveis e em pacientes com diabetes tipo 1 ou tipo 2 (ver Figura 1).
Figura 1: Alterações médias nas concentrações séricas livres de insulina (µU / mL) em pacientes com diabetes tipo 2 após Administração de doses únicas de insulina inalada de Exubera (6 mg) e insulina humana normal subcutânea (18U)
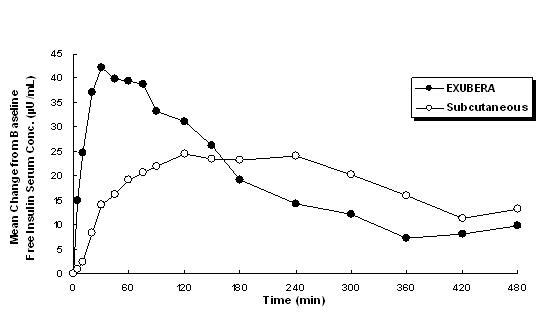
Em estudos clínicos em pacientes com diabetes tipo 1 e tipo 2, após a inalação de Exubera, a insulina sérica atingiu o pico de concentração mais rapidamente do que após injeção subcutânea de insulina humana regular, 49 minutos (intervalo de 30 a 90 minutos) em comparação com 105 minutos (intervalo de 60 a 240 minutos), respectivamente.
Em estudos clínicos, a absorção de insulina humana regular subcutânea diminuiu com o aumento do índice de massa corporal (IMC) do paciente. No entanto, a absorção de insulina após a inalação de Exubera foi independente do IMC.
Num estudo em indivíduos saudáveis, a exposição sistémica à insulina (AUC e Cmax) após a administração de Exubera aumentou com a dose no intervalo de 1 a 6 mg quando administrado como combinações de 1 e 3 mg bolhas.
Num estudo em que a forma de dosagem de três blisters de 1 mg foi comparada com uma blister de 3 mg, a Cmáx e a AUC após a administração de três blisters de 1 mg eram aproximadamente 30% e 40% maiores, respectivamente, do que após a administração de um blister de 3 mg (ver DOSAGEM E ADMINISTRAÇÃO).
Distribuição e Eliminação
Como a insulina humana recombinante é idêntica à insulina endógena, espera-se que a distribuição e eliminação sistêmica sejam as mesmas. No entanto, isso não foi confirmado para Exubera.
Farmacodinâmica
Exubera, como os análogos da insulina de ação rápida administrados por via subcutânea, tem um início mais rápido da atividade de redução da glicose do que a insulina humana normal administrada por via subcutânea. Em voluntários saudáveis, a duração da atividade redutora de glicose de Exubera foi comparável à subcutânea administrou insulina humana regular e mais tempo do que os análogos de insulina de ação rápida administrados por via subcutânea Figura 2).
Figura 2. Taxa média de infusão de glicose (GIR) normalizada para GIRmax para cada assunto sujeito ao tempo em voluntários saudáveis

* Determinado como a quantidade de glicose infundida para manter constantes concentrações plasmáticas de glicose, normalizadas para valores máximos (porcentagem dos valores máximos); indicativo de atividade da insulina.
Quando o Exubera é inalado, o início da atividade de redução da glicose em voluntários saudáveis ocorre dentro de 10 a 20 minutos. O efeito máximo na redução da glicose é exercido aproximadamente 2 horas após a inalação. A duração da atividade de redução da glicose é de aproximadamente 6 horas.
Nos doentes com diabetes tipo 1 ou tipo 2, o Exubera tem um efeito maior de redução da glicose nas primeiras duas horas após a administração, quando comparado com a insulina humana normal administrada por via subcutânea.
A variabilidade intra-indivíduo da atividade de Exubera para baixar a glicose é geralmente comparável à da insulina humana normal administrada por via subcutânea em pacientes com diabetes tipo 1 e 2.
Populações Especiais
Pacientes pediátricos
Em crianças (6-11 anos) e adolescentes (12-17 anos) com diabetes tipo 1, o tempo para atingir o pico de concentração de insulina para Exubera foi alcançada mais rapidamente do que na insulina humana normal subcutânea, o que é consistente com as observações em pacientes adultos com tipo 1 diabetes.
Pacientes Geriátricos
Não existem diferenças aparentes nas propriedades farmacocinéticas de Exubera ao comparar pacientes com idade superior a 65 anos e pacientes adultos mais jovens.
Gênero
Em indivíduos com e sem diabetes, não foram observadas diferenças aparentes nas propriedades farmacocinéticas de Exubera entre homens e mulheres.
Raça
Foi realizado um estudo em 25 indivíduos saudáveis, caucasianos e japoneses, não diabéticos, para comparar os farmacocinéticas e farmacodinâmicas de Exubera, em comparação com a injeção subcutânea de insulina. As propriedades farmacocinéticas e farmacodinâmicas de Exubera foram comparáveis entre as duas populações.
Obesidade
A absorção de Exubera é independente do IMC do paciente.
Insuficiência renal
O efeito da insuficiência renal na farmacocinética de Exubera não foi estudado. Pode ser necessário um monitoramento cuidadoso da glicose e ajustes de dose de insulina em pacientes com disfunção renal (ver PRECAUÇÕES, Insuficiência renal).
Compromisso hepático
O efeito da insuficiência hepática na farmacocinética de Exubera não foi estudado. Pode ser necessário um monitoramento cuidadoso da glicose e ajustes de dose de insulina em pacientes com disfunção hepática (ver PRECAUÇÕES).
Gravidez
A absorção de Exubera em pacientes grávidas com diabetes gestacional e pré-gestacional tipo 2 foi consistente com a de pacientes não gestantes com diabetes tipo 2 (ver PRECAUÇÕES).
Fumar
Em fumantes, espera-se que a exposição sistêmica à insulina para Exubera seja 2 a 5 vezes maior que em não fumantes. Exubera está contra-indicado em pacientes que fumam ou que deixaram de fumar menos de 6 meses antes do início da terapia com Exubera. Se um paciente começar ou continuar a fumar, Exubera deve ser interrompido imediatamente devido ao aumento do risco de hipoglicemia, e um tratamento alternativo deve ser utilizado (consulte CONTRA-INDICAÇÕES).
Nos estudos clínicos de Exubera em 123 pacientes (69 dos quais eram fumantes), os fumantes experimentaram um início mais rápido da ação de redução da glicose, maior efeito máximo e maior efeito total de redução da glicose (principalmente durante as primeiras 2-3 horas após a administração), em comparação com não fumantes.
Fumo passivo de cigarro
Em contraste com o aumento da exposição à insulina após o tabagismo ativo, quando Exubera foi administrado a 30 voluntários saudáveis não fumantes após 2 horas de exposição à fumaça passiva de cigarro em um ambiente experimental controlado, a AUC e a Cmax da insulina foram reduzidas em aproximadamente 20% e 30%, respectivamente. A farmacocinética de Exubera não foi estudada em não-fumantes cronicamente expostos à fumaça passiva de cigarros.
Pacientes com doenças pulmonares subjacentes
O uso de Exubera em pacientes com doença pulmonar subjacente, como asma ou DPOC, não é recomendado porque a segurança e eficácia de Exubera nessa população não foram estabelecidas (ver ADVERTÊNCIAS). O uso de Exubera é contra-indicado em pacientes com doença pulmonar instável ou mal controlada, devido à grande variações na função pulmonar que possam afetar a absorção de Exubera e aumentar o risco de hipoglicemia ou hiperglicemia (ver CONTRA-INDICAÇÕES).
Num estudo farmacocinético em 24 indivíduos não diabéticos com asma leve, a absorção de insulina após a administração de Exubera, na ausência de tratamento com broncodilatador, foi aproximadamente 20% menor que a absorção observada em indivíduos sem asma. Contudo, em um estudo em 24 indivíduos não diabéticos com Doença Pulmonar Obstrutiva Crônica (DPOC), a A exposição após a administração de Exubera foi aproximadamente duas vezes superior à dos indivíduos normais sem DPOC (consulte PRECAUÇÕES).
Administração de albuterol 30 minutos antes da administração de Exubera em indivíduos não diabéticos com asma leve (n = 36) e moderada asma (n = 31) resultou em um aumento médio na AUC e na Cmax da insulina entre 25 e 50% em comparação com quando Exubera foi administrado isoladamente (ver PRECAUÇÕES).
topo
Estudos clínicos
A segurança e eficácia de Exubera foram estudadas em aproximadamente 2500 doentes adultos com diabetes tipo 1 e tipo 2. O principal parâmetro de eficácia para a maioria dos estudos foi o controle glicêmico, medido pela redução da hemoglobina A1c (HbA1c) na linha de base.
Diabetes tipo 1
Um estudo de controle ativo, randomizado, aberto, de 24 semanas (Estudo A) foi realizado em pacientes com diabetes tipo 1 para avaliar a segurança e eficácia de O Exubera administrou três vezes ao dia (TID) antes da refeição com uma única injeção noturna de Humulin® U Ultralente® (suspensão prolongada de insulina de zinco humana) (n = 136). O tratamento comparador foi insulina humana regular subcutânea administrada duas vezes ao dia (BID) (pré-café da manhã e pré-jantar) com injeção BID de insulina humana NPH (suspensão de isofano de insulina humana) (n = 132). Neste estudo, a idade média foi de 38,2 anos (variação: 20-64) e 52% dos indivíduos eram do sexo masculino.
Um segundo estudo de controle ativo, randomizado e aberto de 24 semanas (Estudo B) foi realizado em pacientes com diabetes tipo 1 para avaliar a segurança e eficácia de Exubera (n = 103) em comparação com insulina humana normal subcutânea (n = 103) quando administrado TID antes de refeições. Nos dois grupos de tratamento, a insulina humana NPH recebeu BID (de manhã e ao deitar) como insulina basal. Neste estudo, a idade média foi de 38,4 anos (variação: 19-65) e 54% dos indivíduos eram do sexo masculino.
Em cada estudo, a redução da HbA1c e as taxas de hipoglicemia foram comparáveis nos dois grupos de tratamento. Os pacientes tratados com Exubera tiveram uma redução maior na glicemia de jejum do que os pacientes do grupo comparador. A porcentagem de pacientes que atingem um nível de HbA1c <8% (por ação do tratamento da American Diabetes Association Nível no momento da realização do estudo) e um nível de HbA1c <7% foi comparável entre os dois grupos de tratamento. Os resultados dos Estudos A e B são mostrados na Tabela 2.
Tabela 2: Resultados de dois ensaios abertos de controle ativo e de 24 semanas em pacientes com diabetes tipo 1 (estudos A e B)
| Estudo A | Estudo B | |||
|---|---|---|---|---|
| Exubera (TID) + UL (QD) | SC R (BID) + NPH (BID) | Exubera (TID) + NPH (BID) | SC R (TID) + NPH (BID) | |
| Tamanho da amostra | 136 | 132 | 103 | 103 |
| UL = Humulina® U Ultralente®; SC R = insulina humana regular subcutânea | ||||
| ||||
| HbA1c (%) | ||||
| Média da linha de base | 7.9 | 8.0 | 7.8 | 7.8 |
| Adj. mudança média da linha de base | -0.2 | -0.4 | -0.3 | -0.2 |
| Exubera menos SC R* | 0.14 | -0.11 | ||
| IC 95% para diferença de tratamento | (-0.03, 0.32) | (-0.30, 0.08) | ||
| Glicose plasmática em jejum (mg / dL) | ||||
| Média da linha de base | 191 | 198 | 178 | 191 |
| Adj. mudança média da linha de base | -32 | -6 | -23 | 13 |
| Exubera menos SC R | -27 | -35 | ||
| IC 95% para diferença de tratamento | (-47, -6) | (-58, -13) | ||
| Concentração de glicose pós-prandial de 2 horas (mg / dL) | ||||
| Média da linha de base | 283 | 305 | 273 | 293 |
| Adj. mudança média da linha de base | -21 | 14 | -1 | -3 |
| Exubera menos SC R | -35 | 2 | ||
| IC 95% para diferença de tratamento | (-61, -8) | (-29, 32) | ||
| Pacientes com HbA no final do estudo1c < 8%†| 64.0% | 68.2% | 74.8% | 66.0% |
| Pacientes com HbA no final do estudo1c < 7% | 16.9% | 19.7% | 28.2% | 30.1% |
| Peso corporal | ||||
| Média da linha de base (kg) | 77.4 | 76.4 | 76.0 | 76.9 |
| Adj. variação média da linha de base (kg) | 0.4 | 1.1 | 0.4 | 0.6 |
| Exubera menos SC R | -0.72 | -0.24 | ||
| IC 95% para diferença de tratamento | (-1.48, 0.04) | (-1.07, 0.59) | ||
| Dose diária de insulina no final do estudo | ||||
| Insulina de ação curta | 13,4 mgc | 18,3 UI | 10,9 mgc | 25,7 UI |
| Insulina de ação prolongada | 26,4 UI | 37,1 UI | 31,5 UI | 31,9 UI |
Diabetes tipo 2
Monoterapia em pacientes não controlados de maneira ideal com dieta e tratamento com exercícios
Foi realizado um estudo de controle ativo, randomizado e de 12 semanas (Estudo C) em pacientes com diabetes tipo 2 que não era ideal controlado com dieta e exercício, avaliando a segurança e eficácia do TID Exubera antes da refeição (n = 75) em comparação com agente sensibilizante à insulina. Neste estudo, a idade média foi de 53,7 anos (variação: 28-80), 55% dos indivíduos eram do sexo masculino e o índice de massa corporal médio foi de 32,3 kg / m2.
Às 12 semanas, HbA1c os níveis em pacientes tratados com Exubera diminuíram 2,2% (DP = 1,0), em relação a uma linha de base de 9,5% (DP = 1,1). A proporção de pacientes tratados com Exubera atingindo uma HbA no final do estudo1c nível <8% aumentou para 82,7%. A proporção de pacientes tratados com Exubera atingindo uma HbA no final do estudo1c nível de
Monoterapia e terapia complementar em pacientes tratados anteriormente com terapia com agente oral
Foi realizado um estudo de controle ativo, randomizado, de 12 semanas (estudo D), em pacientes com 2 diabetes que estavam atualmente em tratamento, mas estavam mal controlados, com dois agentes orais (OA). Os OAs basais incluíam um secretagogo de insulina e metformina ou tiazolidinediona. Os pacientes foram randomizados para um dos três braços: continuar o tratamento com OA sozinho (n = 96), mudar para monoterapia com TID Exubera antes da refeição (n = 102) ou adição de TID Exubera antes da refeição à terapia contínua com OA (n = 100). Neste estudo, a idade média foi de 57,4 anos (variação: 33-80), 66% dos indivíduos eram do sexo masculino e o índice de massa corporal médio foi de 30 kg / m2.
Exubera em monoterapia e Exubera em combinação com terapia OA foram superiores à terapia OA isoladamente na redução da HbA1c níveis desde a linha de base. As taxas de hipoglicemia para os dois grupos de tratamento com Exubera foram um pouco mais altas do que no grupo isolado de OA. Comparado apenas à terapia com OA, a porcentagem de pacientes que atingiram uma HbA1c <8% (por nível de ação do tratamento da American Diabetes Association no momento da realização do estudo) e um HbA1c um nível <7% foi maior nos pacientes tratados com Exubera em monoterapia e Exubera em combinação com a terapia com OA. Os pacientes nos dois grupos de tratamento Exubera apresentaram maiores reduções na glicemia de jejum do que os pacientes tratados apenas com terapia OA. Os resultados do Estudo D são mostrados na Tabela 3.
Tabela 3: Resultados de um estudo de 12 semanas de controle ativo e aberto em pacientes com diabetes tipo 2 não idealmente controlados com terapia com agente oral duplo (estudo D)
| Estudo D | Exubera monoterapia | OAs* | Exubera + OAs |
|---|---|---|---|
| Tamanho da amostra | 102 | 96 | 100 |
| |||
| HbA1c (%) | |||
| Média da linha de base | 9.3 | 9.3 | 9.2 |
| Adj. mudança média da linha de base | -1.4 | -0.2 | -1.9 |
| Grupo Exubera menos OAs†| -1.18†,c, § | -1.67†, ¶, § | |
| IC 95% para diferença de tratamento | (-1.41, -0.95) | (-1.90, -1.44) | |
| Glicose plasmática em jejum (mg / dL) | |||
| Média da linha de base | 203 | 203 | 195 |
| Adj. mudança média da linha de base | -23 | 1 | -53 |
| Grupo Exubera menos OAs | -24c | -53 ¶ | |
| IC 95% para diferença de tratamento | (-36, -11) | (-66, -41) | |
| Pacientes com HbA no final do estudo1c < 8%# | 55.9% | 18.8% | 86.0% |
| Pacientes com HbA no final do estudo1c < 7% | 16.7% | 1.0% | 32.0% |
| Peso corporal | |||
| Média da linha de base (kg) | 89.5 | 88.0 | 88.6 |
| Adj. variação média da linha de base (kg) | 2.8 | 0.0 | 2.7 |
| Grupo Exubera menos OAs | 2.80c | 2.75 ¶ | |
| IC 95% para diferença de tratamento | (1.94, 3.65) | (1.89, 3.61) |
Um estudo de controle ativo, randomizado e aberto de 24 semanas (Estudo E) foi realizado em pacientes com diabetes tipo 2, atualmente em uso de terapia com sulfonilureia. Este estudo foi desenvolvido para avaliar a segurança e eficácia da adição de Exubera antes da refeição aos terapia com sulfonilureia (n = 214) em comparação com a adição de metformina antes da refeição à terapia continuada com sulfonilureia (n = 196). Os indivíduos foram estratificados de acordo com a HbA1c na Semana -1. Dois estratos foram definidos: um baixo estrato de HbA1c (HbA1c <8% a <9,5%) e um HbA alto1c estrato (HbA1c > 9,5 a <12%).
Exubera em combinação com sulfonilureia foi superior à metformina e sulfonilureia na redução dos valores de HbA1c da linha de base no grupo de estrato alto. Exubera em combinação com sulfonilureia foi comparável à metformina em combinação com sulfonilureia na redução dos valores de HbA1c da linha de base no grupo de baixo estrato. A taxa de hipoglicemia foi maior após a adição de Exubera à sulfonilureia do que após a adição de metformina à sulfonilureia. A porcentagem de pacientes que atingiram os valores alvo de HbA1c de 8% e 7% foi comparável entre os grupos de tratamento em ambos os estratos, assim como a redução na glicemia de jejum (ver Quadro 4).
Outro estudo de controle ativo, randomizado e aberto de 24 semanas (Estudo F) foi realizado em pacientes com diabetes tipo 2, atualmente em uso de metformina. Este estudo foi desenvolvido para avaliar a segurança e eficácia da adição de Exubera antes da refeição aos terapia com metformina (n = 234) em comparação com a adição de glibenclamida antes da refeição à terapia continuada com metformina (n = 222). Os sujeitos deste estudo também foram estratificados em um dos dois estratos, conforme definido no Estudo E.
Exubera em combinação com metformina foi superior à glibenclamida e metformina na redução da HbA1c valores da linha de base e atingir a meta de HbA1c valores no grupo de estrato alto. Exubera em combinação com metformina foi comparável à glibenclamida em combinação com metformina na redução da HbA1c valores da linha de base e atingir a meta de HbA1c valores no grupo de baixo estrato. A taxa de hipoglicemia foi ligeiramente maior após a adição de Exubera à metformina do que após a adição de glibenclamida à metformina. A redução da glicemia de jejum foi comparável entre os grupos de tratamento (ver Quadro 4).
Tabela 4: Resultados de dois ensaios clínicos abertos de 24 semanas, controle ativo, em pacientes com diabetes tipo 2 anteriormente em terapia com agentes orais (estudos E e F)
| Estudo E | Estudo F | |||||||
|---|---|---|---|---|---|---|---|---|
| Exubera + SU* | Conheceu*+ SU* | Exubera + SU* | Conheceu*+ SU* | Exubera + Met* | Gli* + Encontrado* | Exubera + Met* | Gli* + Encontrado* | |
| Estrato alto†| Estrato baixo†| Estrato alto†| Estrato baixo†| |||||
| Tamanho da amostra | 113 | 103 | 101 | 93 | 109 | 103 | 125 | 119 |
| ||||||||
| HbA1c (%) | ||||||||
| Média da linha de base | 10.5 | 10.6 | 8.8 | 8.8 | 10.4 | 10.6 | 8.6 | 8.7 |
| Adj. mudança média da linha de base | -2.2 | -1.8 | -1.9 | -1.9 | -2.2 | -1.9 | -1.8 | -1.9 |
| Exubera menos OAc | -0.38c, § | -0.07 | -0.37c, ¶ | 0.04 | ||||
| IC 95% para diferença de tratamento | (-0.63, -0.14) | (-0.33, 0.19) | (-0.62, -0.12) | (-0.19, 0.27) | ||||
| Glicose plasmática em jejum (mg / dL) | ||||||||
| Média da linha de base | 241 | 237 | 197 | 198 | 223 | 243 | 187 | 196 |
| Alteração média da linha de base | -46 | -47 | -48 | -52 | -42 | -40 | -46 | -49 |
| Exubera menos OA | 1 | 4 | -2 | 4 | ||||
| IC 95% para diferença de tratamento | (-11, 12) | (-8, 16) | (-14, 10) | (-7, 15) | ||||
| Indivíduos com HbA no final do estudo1c < 8%# | 48.7% | 44.7% | 81.2% | 73.1% | 72.5% | 56.3% | 80.8% | 86.6% |
| Indivíduos com HbA no final do estudo1c < 7% | 20.4% | 14.6% | 30.7% | 32.3% | 33.9% | 17.5% | 40.0% | 42.9% |
| Peso corporal | ||||||||
| Média da linha de base (kg) | 80.8 | 79.5 | 79.9 | 81.9 | 88.3 | 87.8 | 90.3 | 88.2 |
| Adj. variação média da linha de base (kg) | 3.6 | -0.0 | 2.4 | -0.3 | 2.8 | 2.5 | 2.0 | 1.6 |
| Exubera menos OA | 3.60 | 2.67 | 0.26 | 0.38 | ||||
| IC 95% para diferença de tratamento | (2.81, 4.39) | (1.84, 3.51) | (-0.70, 1.21) | (-0.52, 1.27) |
Uso em pacientes previamente tratados com insulina subcutânea
Foi realizado um estudo de controle ativo, randomizado, aberto, por 24 semanas (Estudo G) em pacientes tratados com insulina com tipo 2 diabetes para avaliar a segurança e eficácia da DID pré-refeição administrada com Exubera com uma única injeção noturna de Humulin® U Ultralente® (n = 146) em comparação com a BID subcutânea regular administrada com insulina humana (antes do café da manhã e antes do jantar) com injeção BID de insulina humana NPH (n = 149). Neste estudo, a idade média foi de 57,5 anos (variação: 23-80), 66% dos indivíduos eram do sexo masculino e o índice de massa corporal médio foi de 30,3 kg / m2.
As reduções da linha de base na HbA1c, porcentagem de pacientes atingindo uma HbA1c <8% (por nível de ação do tratamento da American Diabetes Association no momento da realização do estudo) e um HbA1c nível <7%, bem como as taxas de hipoglicemia, foram semelhantes entre os grupos de tratamento. Os pacientes tratados com Exubera tiveram uma redução maior na glicemia de jejum do que os pacientes do grupo comparador. Os resultados do Estudo G são mostrados na Tabela 5.
Tabela 5: Resultados de um ensaio aberto de 24 semanas com controle ativo e controle em pacientes com diabetes tipo 2 previamente tratados com insulina subcutânea (estudo G)
| Estudo G | Exubera (TID) + UL (QD) | SC R (BID) + NPH (BID) |
|---|---|---|
| Tamanho da amostra | 146 | 149 |
| UL = Humulina® U Ultralente®; SC R = insulina humana regular subcutânea | ||
| ||
| HbA1c (%) | ||
| Média da linha de base | 8.1 | 8.2 |
| Adj. mudança média da linha de base | -0.7 | -0.6 |
| Exubera menos SC R* | -0.07 | |
| IC 95% para diferença de tratamento | (-0.31, 0.17) | |
| Glicose plasmática em jejum (mg / dL) | ||
| Média da linha de base | 152 | 159 |
| Adj. mudança média da linha de base | -22 | -6 |
| Exubera menos SC R | -16.36 | |
| IC 95% para diferença de tratamento | (-27.09, -5.36) | |
| Pacientes com HbA no final do estudo1c < 8%†| 76.0% | 69.1% |
| Pacientes com HbA no final do estudo1c < 7% | 45.2% | 32.2% |
| Peso corporal | ||
| Média da linha de base (kg) | 90.6 | 89.0 |
| Adj. variação média da linha de base (kg) | 0.1 | 1.3 |
| Exubera menos SC R | -1.28 | |
| IC 95% para diferença de tratamento | (-1.96, -0.60) | |
| Dose diária de insulina no final do estudo | ||
| Insulina de ação curta | 16,6 mgc | 25,5 UI |
| Insulina de ação prolongada | 37,9 UI | 52,3 UI |
topo
Indicações e uso
Exubera está indicado no tratamento de pacientes adultos com diabetes mellitus para o controle da hiperglicemia. Exubera tem um início de ação semelhante aos análogos de insulina de ação rápida e tem uma duração de atividade redutora de glicose comparável à insulina humana normal administrada por via subcutânea. Em pacientes com diabetes tipo 1, Exubera deve ser usado em regimes que incluem insulina de ação mais prolongada. Em pacientes com diabetes tipo 2, Exubera pode ser usado como monoterapia ou em combinação com agentes orais ou insulinas de ação mais longa.
topo
Contra-indicações
Exubera está contra-indicado em pacientes hipersensíveis a Exubera ou a um de seus excipientes.
Exubera está contra-indicado em pacientes que fumam ou que deixaram de fumar menos de 6 meses antes do início da terapia com Exubera. Se um paciente começar ou continuar a fumar, Exubera deve ser interrompido imediatamente devido ao aumento do risco de hipoglicemia, e um tratamento alternativo deve ser utilizado (consulte FARMACOLOGIA CLÍNICA, Populações Especiais, Tabagismo). A segurança e eficácia de Exubera em pacientes que fumam não foram estabelecidas.
Exubera está contra-indicado em pacientes com doença pulmonar instável ou mal controlada, devido a grandes variações na função pulmonar que pode afetar a absorção de Exubera e aumentar o risco de hipoglicemia ou hiperglicemia.
topo
Advertências
Exubera difere da insulina humana comum pelo seu rápido início de ação. Quando utilizada como insulina durante as refeições, a dose de Exubera deve ser administrada 10 minutos antes da refeição.
A hipoglicemia é o evento adverso mais relatado na terapia com insulina, incluindo Exubera. O momento da hipoglicemia pode diferir entre várias formulações de insulina.
Pacientes com diabetes tipo 1 também necessitam de insulina de ação mais prolongada para manter um controle adequado da glicose.
Qualquer mudança de insulina deve ser feita com cautela e somente sob supervisão médica. Alterações na resistência à insulina, fabricante, tipo (por exemplo, regular, NPH, análogos) ou espécie (animal, humano) podem resultar na necessidade de uma alteração na dosagem. O tratamento antidiabético oral concomitante pode precisar ser ajustado.
O monitoramento da glicose é recomendado para todos os pacientes com diabetes.
Devido ao efeito de Exubera na função pulmonar, todos os pacientes devem ter a função pulmonar avaliada antes de iniciar o tratamento com Exubera (ver PRECAUÇÕES: Função pulmonar).
O uso de Exubera em pacientes com doença pulmonar subjacente, como asma ou DPOC, não é recomendado porque a segurança e eficácia de Exubera nessa população não foram estabelecidas (ver PRECAUÇÕES: Doença pulmonar subjacente).
Nos ensaios clínicos de Exubera, houve 6 casos recentemente diagnosticados de neoplasias pulmonares primárias entre pacientes tratados com Exubera e 1 caso diagnosticado recentemente entre pacientes tratados com comparador. Também houve um relatório pós-comercialização de uma malignidade pulmonar primária em um paciente tratado com Exubera. Em ensaios clínicos controlados de Exubera, a incidência de novo câncer de pulmão primário por 100 pacientes-ano de exposição a drogas em estudo foi de 0,13 (5 casos acima de 3900 pacientes / ano) para pacientes tratados com Exubera e 0,02 (1 caso acima de 4100 pacientes / ano) para pacientes tratados com comparador. Havia poucos casos para determinar se o surgimento desses eventos está relacionado ao Exubera. Todos os pacientes diagnosticados com câncer de pulmão tinham histórico prévio de tabagismo.
topo
Precauções
Geral
Como em todas as preparações de insulina, o tempo de ação da Exubera pode variar em indivíduos diferentes ou em momentos diferentes no mesmo indivíduo. O ajuste da dose de qualquer insulina pode ser necessário se os pacientes mudarem sua atividade física ou seu plano habitual de refeição. Os requisitos de insulina podem ser alterados durante condições intercorrentes, como doenças, distúrbios emocionais ou estresse.
Hipoglicemia
Tal como acontece com todas as preparações de insulina, as reações hipoglicêmicas podem estar associadas à administração de Exubera. Mudanças rápidas nas concentrações séricas de glicose podem induzir sintomas semelhantes à hipoglicemia em pessoas com diabetes, independentemente do valor da glicose. Os sintomas de alerta precoce da hipoglicemia podem ser diferentes ou menos pronunciados sob certas condições, como duração do diabetes, doença do nervo diabético, uso de medicamentos como betabloqueadores ou controle intensificado do diabetes (Vejo PRECAUÇÕES: Interações medicamentosas). Tais situações podem resultar em hipoglicemia grave (e, possivelmente, perda de consciência) antes da conscientização dos pacientes sobre hipoglicemia.
Insuficiência renal
Não foram realizados estudos em pacientes com insuficiência renal. Tal como com outras preparações de insulina, os requisitos de dose de Exubera podem ser reduzidos em doentes com compromisso renal (ver FARMACOLOGIA CLÍNICA, Populações Especiais).
Compromisso hepático
Não foram realizados estudos em pacientes com insuficiência hepática. Tal como com outras preparações de insulina, os requisitos de dose de Exubera podem ser reduzidos em doentes com compromisso hepático (ver FARMACOLOGIA CLÍNICA, Populações Especiais).
Alergia
Alergia sistêmica
Em estudos clínicos, a incidência geral de reações alérgicas em pacientes tratados com Exubera foi semelhante à de pacientes em uso de regimes subcutâneos com insulina humana regular.
Tal como acontece com outras preparações de insulina, pode ocorrer alergia generalizada à insulina, rara, mas potencialmente grave, o que pode causar erupção cutânea (incluindo prurido) em todo o corpo, falta de ar, chiado no peito, redução da pressão arterial, pulso rápido ou suando. Casos graves de alergia generalizada, incluindo reações anafiláticas, podem ser fatais. Se ocorrerem tais reações com o Exubera, o Exubera deve ser interrompido e consideradas terapias alternativas.
Produção de anticorpos
Os anticorpos à insulina podem se desenvolver durante o tratamento com todas as preparações de insulina, incluindo Exubera. Nos estudos clínicos de Exubera, em que o comparador era insulina subcutânea, o aumento dos níveis de anticorpos à insulina (refletido nos ensaios de atividade de ligação à insulina) foram significativamente maiores nos pacientes que receberam Exubera do que nos pacientes que receberam insulina subcutânea só. Nenhuma conseqüência clínica desses anticorpos foi identificada ao longo do período de estudos clínicos de Exubera; no entanto, o significado clínico a longo prazo desse aumento na formação de anticorpos é desconhecido.
Respiratório
Função pulmonar
Em ensaios clínicos com duração de até dois anos, os pacientes tratados com Exubera demonstraram um maior declínio na função pulmonar, especificamente o volume expiratório forçado no primeiro segundo (VEF1) e a capacidade de difusão do monóxido de carbono (DLCO), em comparação ao pacientes. A diferença média da função pulmonar do grupo de tratamento, favorecendo o grupo comparador, foi observada no nas primeiras semanas de tratamento com Exubera e não se alterou durante o período de tratamento de dois anos (Vejo REAÇÕES ADVERSAS: Função pulmonar).
Durante os ensaios clínicos controlados, pacientes individuais apresentaram notáveis declínios na função pulmonar em ambos os grupos de tratamento. Um declínio em relação ao VEF1 inicial de <20% na última observação ocorreu em 1,5% dos pacientes tratados com Exubera e em 1,3% dos pacientes tratados com comparador. Um declínio em relação à DL de linha de baseCO de <20% na última observação ocorreu em 5,1% dos pacientes tratados com Exubera e 3,6% dos pacientes tratados com comparador.
Devido ao efeito de Exubera na função pulmonar, todos os pacientes devem ter a espirometria (VEF1) avaliada antes de iniciar a terapia com Exubera. Avaliação de DLCO deve ser considerado. A eficácia e segurança de Exubera em pacientes com VEF basal1 ou DLCO <70% do previsto não foram estabelecidos e o uso de Exubera nesta população não é recomendado.
A avaliação da função pulmonar (por exemplo, espirometria) é recomendada após os primeiros 6 meses de terapia e anualmente a partir daí, mesmo na ausência de sintomas pulmonares. Em pacientes que apresentam um declínio de <20% no VEF1 em relação ao valor basal, os testes de função pulmonar devem ser repetidos. Se for confirmado o declínio de <20% em relação ao VEF1 inicial, o Exubera deve ser descontinuado. A presença de sintomas pulmonares e menor declínio da função pulmonar podem exigir monitoramento mais frequente da função pulmonar e consideração da descontinuação de Exubera.
Doença pulmonar subjacente
O uso de Exubera em pacientes com doença pulmonar subjacente, como asma ou DPOC, não é recomendado porque a eficácia e segurança de Exubera nessa população não foram estabelecidas.
Broncoespasmo
Broncoespasmo tem sido raramente relatado em pacientes que tomam Exubera. Pacientes com essa reação devem interromper o Exubera e procurar avaliação médica imediatamente. A re-administração de Exubera requer uma avaliação cuidadosa dos riscos e só deve ser realizada sob monitoramento médico rigoroso, com instalações clínicas adequadas disponíveis.
Doença Respiratória Intercorrente
Exubera foi administrado a pacientes com doença respiratória intercorrente (por exemplo, bronquite, infecções do trato respiratório superior, rinite) durante estudos clínicos. Em pacientes com essas condições, 3-4% interromperam temporariamente a terapia com Exubera. Não houve aumento do risco de hipoglicemia ou pior controle glicêmico observado em pacientes tratados com Exubera em comparação com pacientes tratados com insulina subcutânea. Durante doenças respiratórias intercorrentes, pode ser necessário um monitoramento rigoroso das concentrações de glicose no sangue e ajuste da dose.
Informação para Pacientes
Os pacientes devem ser instruídos sobre procedimentos de autogestão, incluindo monitoramento de glicose; técnica adequada de inalação de Exubera; e gerenciamento de hipoglicemia e hiperglicemia. Os pacientes devem ser instruídos a lidar com situações especiais, como condições intercorrentes (doença, estresse ou estresse emocional). distúrbios), uma dose inadequada ou ignorada de insulina, administração inadvertida de uma dose aumentada de insulina, ingestão inadequada de alimentos ou refeições puladas.
Os pacientes devem ser informados de que, em estudos clínicos, o tratamento com Exubera foi associado a pequenos declínios médios não progressivos da função pulmonar em relação aos tratamentos comparadores. Devido ao efeito de Exubera na função pulmonar, os testes de função pulmonar são recomendados antes do início do tratamento com Exubera. Após o início da terapêutica, são recomendados testes periódicos da função pulmonar (ver PRECAUÇÕES Função respiratória, pulmonar).
Os doentes devem informar o seu médico se tiverem história de doença pulmonar, porque o uso de Exubera não é recomendado em pacientes com doença pulmonar subjacente (por exemplo, asma ou DPOC) e é contra-indicado em pacientes com doença pulmonar mal controlada doença.
As mulheres com diabetes devem ser aconselhadas a informar seu médico se estiverem grávidas ou estiverem pensando em engravidar.
topo
Interações medicamentosas
Várias substâncias afetam o metabolismo da glicose e podem exigir ajuste da dose de insulina e monitoramento particularmente próximo.
A seguir, exemplos de substâncias que podem reduzir o efeito da insulina na redução da glicose no sangue, que pode resultar em hiperglicemia: corticosteróides, danazol, diazóxido, diuréticos, agentes simpatomiméticos (por exemplo, epinefrina, albuterol, terbutalina), glucagon, isoniazida, derivados da fenotiazina, somatropina, hormônios da tireóide, estrógenos, progestógenos (por exemplo, em contraceptivos orais), inibidores de protease e medicamentos antipsicóticos atípicos (por exemplo, olanzapina e clozapina).
A seguir, exemplos de substâncias que podem aumentar o efeito da insulina na redução da glicose no sangue e a suscetibilidade à hipoglicemia: produtos antidiabéticos, inibidores da ECA, disopiramida, fibratos, fluoxetina, inibidores da MAO, pentoxifilina, propoxifeno, salicilatos e sulfonamida antibióticos.
Betabloqueadores, clonidina, sais de lítio e álcool podem aumentar ou reduzir o efeito da insulina na redução da glicose no sangue. A pentamidina pode causar hipoglicemia, que às vezes pode ser seguida por hiperglicemia.
Além disso, sob a influência de medicamentos simpatolíticos, como betabloqueadores, clonidina, guanetidina e reserpina, os sinais e sintomas de hipoglicemia podem estar reduzidos ou ausentes.
Broncodilatadores e outros produtos inalados podem alterar a absorção da insulina humana inalada (consulte FARMACOLOGIA CLÍNICA, Populações Especiais). Recomenda-se um tempo consistente de dosagem dos broncodilatadores em relação à administração de Exubera, monitoramento rigoroso das concentrações de glicose no sangue e titulação da dose, conforme apropriado.
Carcinogênese, mutagênese, comprometimento da fertilidade
Não foram realizados estudos de carcinogenicidade em animais em dois anos. A insulina não foi mutagênica no teste de mutação reversa bacteriana de Ames na presença e ausência de ativação metabólica.
Em ratos Sprague-Dawley, foi realizado um estudo de toxicidade de dose repetida por 6 meses com pó para inalação de insulina em doses de até 5,8 mg / kg / dia (em comparação com a clínica). dose inicial de 0,15 mg / kg / dia, a dose alta do rato foi de 39 vezes ou 8,3 vezes a dose clínica, com base em uma comparação de mg / kg ou mg / m2 de área de superfície corporal). Nos macacos Cynomolgus, foi realizado um estudo de toxicidade por dose repetida por 6 meses com insulina inalada em doses de até 0,64 mg / kg / dia. Comparada à dose inicial clínica de 0,15 mg / kg / dia, a dose alta do macaco foi de 4,3 vezes ou 1,4 vezes a dose clínica, com base na comparação da área de superfície corporal mg / kg ou mg / m2. Estas eram doses máximas toleradas com base na hipoglicemia.
Comparado aos animais controle, não houve efeitos adversos relacionados ao tratamento em nenhuma espécie na função pulmonar, na morfologia macroscópica ou microscópica do trato respiratório ou nos linfonodos brônquicos. Da mesma forma, não houve efeito sobre os índices de proliferação celular na área alveolar ou bronquiolar do pulmão em ambas as espécies.
Como a insulina humana recombinante é idêntica ao hormônio endógeno, não foram realizados estudos de reprodução / fertilidade em animais.
Gravidez
Efeitos teratogênicos
Gravidez Categoria C
Não foram realizados estudos de reprodução animal com Exubera. Também não se sabe se Exubera pode causar danos fetais quando administrado a uma mulher grávida ou se Exubera pode afetar a capacidade reprodutiva. Exubera deve ser administrado a uma mulher grávida apenas se for claramente necessário.
Mães que amamentam
Muitos medicamentos, incluindo insulina humana, são excretados no leite humano. Por esse motivo, deve-se ter cuidado quando Exubera é administrado a uma mulher que amamenta. Pacientes com diabetes que estão amamentando podem precisar de ajustes na dose de Exubera, no plano de refeições ou em ambos.
Uso pediátrico
A segurança e eficácia a longo prazo de Exubera em doentes pediátricos não foram estabelecidas (ver FARMACOLOGIA CLÍNICA, Populações Especiais).
Uso Geriátrico
Nos estudos clínicos controlados de Fase 2/3 (n = 1975), Exubera foi administrado a 266 pacientes com idade> 65 anos e 30 pacientes com idade superior a 75 anos. A maioria desses pacientes tinha diabetes tipo 2. A mudança na HbA1C e taxa de hipoglicemia não diferiram por idade.
topo
Reações adversas
A segurança de Exubera isoladamente, ou em combinação com insulina subcutânea ou agentes orais, foi avaliadas em aproximadamente 2500 pacientes adultos com diabetes tipo 1 ou 2 expostos a Exubera. Aproximadamente 2000 pacientes foram expostos a Exubera por mais de 6 meses e mais de 800 pacientes foram expostos por mais de 2 anos.
Eventos adversos não respiratórios
Os eventos adversos não respiratórios relatados em <1% dos pacientes tratados com Exubera em 1977 nos estudos clínicos controlados de Fase 2/3, independentemente da causalidade, incluem (mas não estão limitados a) o seguinte:
Metabólico e Nutricional: hipoglicemia (ver ADVERTÊNCIAS e PRECAUÇÕES)
Corpo como um todo: dor no peito
Digestivo: boca seca
Sentidos especiais: otite média (diabéticos pediátricos tipo 1)
Hipoglicemia
As taxas e a incidência de hipoglicemia foram comparáveis entre Exubera e insulina humana normal subcutânea em pacientes com diabetes tipo 1 e tipo 2. Nos pacientes do tipo 2 que não foram adequadamente controlados com terapia com agente oral único, a adição de Exubera foi associado a uma maior taxa de hipoglicemia do que a adição de uma segunda via oral agente.
Dor no peito
Uma variedade de sintomas torácicos diferentes foram relatados como reações adversas e foram agrupados sob o termo não específico de dor no peito. Esses eventos ocorreram em 4,7% dos pacientes tratados com Exubera e em 3,2% dos pacientes nos grupos comparadores. A maioria (> 90%) desses eventos foi relatada como leve ou moderada. Dois pacientes no Exubera e um no grupo comparador interromperam o tratamento devido a dor no peito. A incidência de eventos adversos por toda a causalidade relacionados à doença arterial coronariana, como angina de peito ou infarto do miocárdio, foi comparável no Exubera (0,7% de angina de peito; Infarto do miocárdio a 0,7%) e comparador (angina de peito a 1,3%; Grupos de tratamento com infarto do miocárdio a 0,7%).
Boca seca
A boca seca foi relatada em 2,4% dos pacientes tratados com Exubera e em 0,8% dos pacientes nos grupos comparadores. Quase toda a boca seca (> 98%) relatada foi leve ou moderada. Nenhum paciente interrompeu o tratamento devido à boca seca.
Eventos da orelha em diabéticos pediátricos
Os diabéticos pediátricos tipo 1 nos grupos Exubera sofreram eventos adversos relacionados ao ouvido com mais freqüência do que os diabéticos pediátricos tipo 1 nos grupos de tratamento que receberam apenas insulina subcutânea. Esses eventos incluíram otite média (Exubera 6,5%; SC 3,4%), dor de ouvido (Exubera 3,9%; SC 1,4%) e distúrbio do ouvido (Exubera 1,3%; SC 0%).
Eventos adversos respiratórios
A Tabela 6 mostra a incidência de eventos adversos respiratórios para cada grupo de tratamento que foram relatados em <1% de qualquer grupo de tratamento nos estudos clínicos controlados de Fase 2 e 3, independentemente da causalidade.
Tabela 6: Eventos adversos respiratórios relatados em <1% de qualquer grupo de tratamento nos estudos clínicos controlados de fase 2 e 3, independentemente da causalidade
| Porcentagem de pacientes que relatam eventos | |||||
|---|---|---|---|---|---|
| Acontecimento adverso | Diabetes tipo 1 | Diabetes tipo 2 | |||
| Exubera N = 698 |
SC N = 705 |
Exubera N = 1279 |
SC N = 488 |
OAs N = 644 |
|
| SC = comparador subcutâneo de insulina; OA = comparadores de agentes orais | |||||
| Infecção do trato respiratório | 43.3 | 42.0 | 29.2 | 38.1 | 19.7 |
| Tosse aumentada | 29.5 | 8.8 | 21.9 | 10.2 | 3.7 |
| Faringite | 18.2 | 16.6 | 9.5 | 9.6 | 5.9 |
| Rinite | 14.5 | 10.9 | 8.8 | 10.5 | 3.0 |
| Sinusite | 10.3 | 7.4 | 5.4 | 10.0 | 2.3 |
| Distúrbio respiratório | 7.4 | 4.1 | 6.1 | 10.2 | 1.7 |
| Dispnéia | 4.4 | 0.9 | 3.6 | 2.5 | 1.4 |
| Aumento do escarro | 3.9 | 1.3 | 2.8 | 1.0 | 0.5 |
| Bronquite | 3.2 | 4.1 | 5.4 | 3.9 | 4.0 |
| Asma | 1.3 | 1.3 | 2.0 | 2.3 | 0.5 |
| Epistaxe | 1.3 | 0.4 | 1.2 | 0.4 | 0.8 |
| Laringite | 1.1 | 0.4 | 0.5 | 0.4 | 0.3 |
| Pneumonia | 0.9 | 1.1 | 0.9 | 1.6 | 0.6 |
| Alteração de voz | 0.1 | 0.1 | 1.3 | 0.0 | 0.3 |
Tosse
Em 3 estudos clínicos, os pacientes que preencheram um questionário de tosse relataram que a tosse tendia a ocorrer dentro de segundos a minutos após a inalação de Exubera, era predominantemente leve e raramente produtiva em natureza. A incidência desta tosse diminuiu com o uso continuado de Exubera. Em estudos clínicos controlados, 1,2% dos pacientes interromperam o tratamento com Exubera devido à tosse.
Dispnéia
Quase todos (> 97%) da dispnéia foram relatados como leves ou moderados. Um pequeno número de pacientes tratados com Exubera (0,4%) interrompeu o tratamento devido à dispnéia em comparação com 0,1% dos pacientes tratados com comparador.
Outros eventos adversos respiratórios - faringite, expectoração aumentada e epistaxe
A maioria desses eventos foi relatada como leve ou moderada. Um pequeno número de pacientes tratados com Exubera interrompeu o tratamento devido a faringite (0,2%) e o escarro aumentou (0,1%); nenhum paciente interrompeu o tratamento devido à epistaxe.
Função pulmonar
O efeito de Exubera no sistema respiratório foi avaliado em mais de 3800 pacientes em estudos clínicos controlados de fase 2 e 3 (nos quais 1977 pacientes foram tratados com Exubera). Em ensaios clínicos randomizados, de rótulo aberto, com duração de até dois anos, os pacientes tratados com Exubera demonstraram um maior declínio na função pulmonar, especificamente o volume expiratório forçado em um segundo (VEF1) e a capacidade de difusão de monóxido de carbono (DLCO), do que pacientes tratados com comparador. As diferenças médias do grupo de tratamento no VEF1 e DLCO, foram observados nas primeiras semanas de tratamento com Exubera e não progrediram durante o período de tratamento de dois anos. Em um estudo clínico controlado controlado em pacientes com diabetes tipo 2 após dois anos de tratamento com Exubera, os pacientes apresentaram resolução da diferença do grupo de tratamento no VEF1 seis semanas após a descontinuação do tratamento. A resolução do efeito de Exubera na função pulmonar em pacientes com diabetes tipo 1 não foi estudada após tratamento a longo prazo.
As figuras 3 a 6 mostram o VEF médio1 e DLCO mudança da linha de base versus o tempo de dois estudos randomizados em aberto de dois anos em 580 pacientes com diabetes tipo 1 e 620 pacientes com diabetes tipo 2.
Figura 3: Alteração do VEF1 basal (L) em pacientes com diabetes tipo 1 (média +/- desvio padrão)
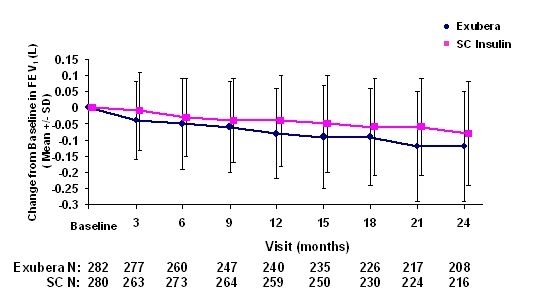
Figura 4: Alteração do VEF1 basal (L) em pacientes com diabetes tipo 2 (média +/- desvio padrão)
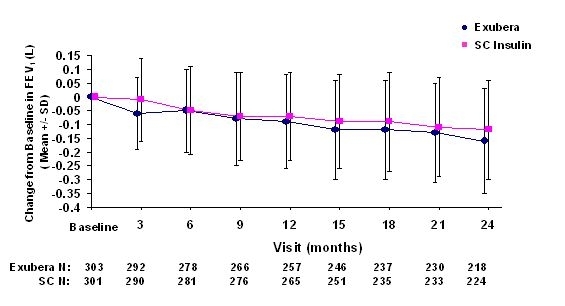
Após 2 anos de tratamento com Exubera em pacientes com diabetes tipo 1 e tipo 2, a diferença entre os grupos de tratamento para a alteração média do VEF1 basal foi de aproximadamente 40 mL, favorecendo a comparador.
Figura 5: Alteração do DLco basal (mL / min / mmHg) em pacientes com diabetes tipo 1 (média +/- desvio padrão)
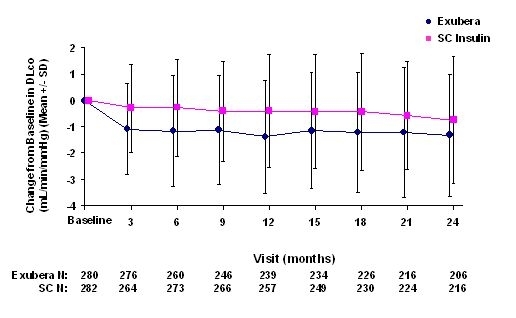
Figura 6: Alteração do DLco basal (mL / min / mmHg) em pacientes com diabetes tipo 2 (média +/- desvio padrão)

Após 2 anos de tratamento com Exubera, a diferença entre os grupos de tratamento para a mudança média em relação ao DL basalCO foi de aproximadamente 0,5mL / min / mmHg (diabetes tipo 1), favorecendo o comparador, e aproximadamente 0,1mL / min / mmHg (diabetes tipo 2), favorecendo o Exubera.
Durante os ensaios clínicos de dois anos, pacientes individuais apresentaram declínios notáveis na função pulmonar em ambos os grupos de tratamento. Um declínio em relação ao VEF basal1 de <20% na última observação ocorreu em 1,5% dos pacientes tratados com Exubera e em 1,3% dos pacientes tratados com comparador. Um declínio em relação à DL de linha de baseCO de <20% na última observação ocorreu em 5,1% dos pacientes tratados com Exubera e 3,6% dos pacientes tratados com comparador.
topo
Sobredosagem
A hipoglicemia pode ocorrer como resultado de um excesso de insulina em relação à ingestão de alimentos, gasto de energia ou ambos.
Episódios leves a moderados de hipoglicemia geralmente podem ser tratados com glicose oral. Podem ser necessários ajustes na dosagem do medicamento, no padrão das refeições ou no exercício.
Episódios graves de hipoglicemia com coma, convulsão ou comprometimento neurológico podem ser tratados com glucagon intramuscular / subcutâneo ou glicose intravenosa concentrada. A ingestão e observação sustentadas de carboidratos podem ser necessárias, porque a hipoglicemia pode ocorrer novamente após aparente recuperação clínica.
topo
Dosagem e Administração
Exubera, como os análogos de insulina de ação rápida, tem um início mais rápido da atividade de redução da glicose em comparação com a insulina humana normal injetada subcutaneamente. Exubera tem uma duração de atividade redutora de glicose comparável à insulina humana normal injetada por via subcutânea e maior que a insulina de ação rápida. As doses de Exubera devem ser administradas imediatamente antes das refeições (não mais que 10 minutos antes de cada refeição).
Em pacientes com diabetes tipo 1, Exubera deve ser usado em regimes que incluem insulina de ação mais prolongada. Para pacientes com diabetes tipo 2, Exubera pode ser usado como monoterapia ou em combinação com agentes orais ou insulina de ação mais prolongada.
Devido ao efeito de Exubera na função pulmonar, todos os pacientes devem ter a função pulmonar avaliada antes de iniciar o tratamento com Exubera. Recomenda-se monitorização periódica da função pulmonar em doentes tratados com Exubera (ver PRECAUÇÕES, Função pulmonar).
Exubera destina-se à administração por inalação e só deve ser administrado com o Exubera® Inalador. Consulte o Exubera Medication Guide para uma descrição do Exubera® Inalador e para obter instruções sobre como usar o inalador.
Cálculo da dose inicial de Exubera pré-refeição
A dose inicial de Exubera deve ser individualizada e determinada com base nos conselhos do médico, de acordo com as necessidades do paciente. As doses iniciais pré-refeição recomendadas são baseadas em ensaios clínicos em que os pacientes foram solicitados a comer três refeições por dia. As doses iniciais pré-refeição podem ser calculadas usando a seguinte fórmula: [Peso corporal (kg) X 0,05 mg / kg = dose pré-refeição (mg)] arredondada para o número miligrama inteiro mais próximo (por exemplo, 3,7 mg arredondada para 3 mg).
As diretrizes aproximadas para doses iniciais de Exubera pré-refeição, com base no peso corporal do paciente, estão indicadas na Tabela 7:
Tabela 7: Diretrizes aproximadas para a dose inicial de Exubera pré-refeição (com base no peso corporal do paciente)
| Peso do paciente (em kg) |
Peso do paciente (em lb) |
Dose inicial por refeição | Número de bolhas de 1 mg por dose | Número de bolhas de 3 mg por dose |
|---|---|---|---|---|
| 30 a 39,9 kg | 66 - 87 lb | 1 mg por refeição | 1 | - |
| 40 a 59,9 kg | 88 - 132 lb | 2 mg por refeição | 2 | - |
| 60 a 79,9 kg | 133 - 176 lb | 3 mg por refeição | - | 1 |
| 80 a 99,9 kg | 177 - 220 lb | 4 mg por refeição | 1 | 1 |
| 100 a 119,9 kg | 221- 264 lb | 5 mg por refeição | 2 | 1 |
| 120 a 139,9 kg | 265 - 308 lb | 6 mg por refeição | - | 2 |
Uma bolha de 1 mg de insulina inalada Exubera é aproximadamente equivalente a 3 UI de insulina humana normal injetada subcutaneamente. Uma bolha de 3 mg de insulina inalada Exubera é aproximadamente equivalente a 8 UI de insulina humana normal injetada subcutaneamente. A Tabela 8 fornece a dose aproximada de UI de insulina humana subcutânea regular para doses de insulina inalada Exubera de 1 mg a 6 mg.
Tabela 8: Dose equivalente aproximada de UI de insulina subcutânea humana normal para doses de insulina inalada Exubera, variando de 1 mg a 6 mg
| Dose (mg) | Dose regular aproximada de insulina SC em UI | Número de 1 mg de Exubera Blisters por dose | Número de 3 mg de Exubera Blisters por dose |
|---|---|---|---|
| 1 mg | 3 | 1 | - |
| 2 mg | 6 | 2 | - |
| 3 mg | 8 | - | 1 |
| 4 mg | 11 | 1 | 1 |
| 5 mg | 14 | 2 | 1 |
| 6 mg | 16 | - | 2 |
Os pacientes devem combinar blisters de 1 mg e 3 mg para que sejam tomados o menor número de blisters por dose (por exemplo, uma dose de 4 mg deve ser administrada como um blister de 1 mg e um blister de 3 mg). A inalação consecutiva de três blisters de dose unitária de 1 mg resulta em exposição à insulina significativamente maior do que a inalação de um blister de dose unitária de 3 mg. Portanto, três doses de 1 mg não devem ser substituídas por uma dose de 3 mg (ver FARMACOLOGIA CLÍNICAFarmacocinética). Quando um paciente é estabilizado com um regime de dosagem que inclui 3 mg de blisters e os 3 mg de blisters ficar temporariamente indisponível, o paciente pode substituir temporariamente duas ampolas de 1 mg por uma de 3 mg bolha. A glicose no sangue deve ser monitorada de perto.
Como com todas as insulinas, fatores adicionais que devem ser levados em consideração ao determinar a dose inicial de Exubera incluem, mas não se limitam ao controle glicêmico atual do paciente, resposta prévia à insulina, duração do diabetes e dieta e exercícios hábitos.
Considerações para titulação de dose
Após o início da terapêutica com Exubera, tal como com outros agentes redutores de glicose, pode ser necessário um ajuste da dose com base no necessidade do paciente (por exemplo, concentrações de glicose no sangue, tamanho da refeição e composição de nutrientes, hora do dia e recentes ou antecipadas exercício). Cada paciente deve ser titulado para sua dosagem ideal com base nos resultados do monitoramento da glicemia.
Como para todas as insulinas, o tempo de ação da Exubera pode variar em indivíduos diferentes ou em momentos diferentes no mesmo indivíduo.
Exubera pode ser utilizado durante doenças respiratórias intercorrentes (por exemplo, bronquite, infecção do trato respiratório superior, rinite). Pode ser necessário monitorar de perto as concentrações de glicose no sangue e ajustar a dose individualmente. Os medicamentos inalados (por exemplo, broncodilatadores) devem ser administrados antes da administração de Exubera.
topo
Como fornecido
Exubera (insulina humana [origem do rDNA]) O pó para inalação está disponível em blisters de dose unitária de 1 mg e 3 mg. Os blisters são dispensados em cartões perfurados de seis blisters de dose unitária (PVC / alumínio). Os dois pontos fortes são diferenciados pela impressão em cores e marcas táteis que podem ser diferenciadas pelo toque. As bolhas de 1 mg e os respectivos cartões perfurados são impressos com tinta verde e os cartões são marcados com uma barra levantada. As bolhas de 3 mg e os respectivos cartões perfurados são impressos com tinta azul e os cartões são marcados com três barras elevadas.
Cinco cartões blister são embalados em uma bandeja termoformada de plástico transparente (PET). Cada bandeja de PET também contém um dessecante e é coberta com uma tampa de plástico transparente (PET). A bandeja de cinco cartões blister (30 blisters de dose unitária) é selada em uma bolsa laminada de papel alumínio com um dessecante.
Exubera (insulina humana [origem do rDNA]) Pó para inalação, um Exubera® Inalador e substituição Exubera® As unidades de liberação são necessárias para iniciar a terapia com Exubera e são fornecidas no kit Exubera. Um Exubera totalmente montado® O inalador consiste na base do inalador, uma câmara e um Exubera® Unidade de liberação. Um inalador totalmente montado é fornecido com uma câmara de substituição e está disponível no kit Exubera e como uma unidade separada. A Câmara também está disponível como um componente individual.
Exubera® As unidades de liberação são embaladas individualmente em uma bandeja termoformada selada. One Exubera® A unidade de liberação está incluída em cada inalador totalmente montado. Duas unidades de liberação adicionais são fornecidas no kit Exubera e em cada pacote de combinação. As unidades de liberação Exubera também estão disponíveis individualmente.
Consulte as Tabelas 9 e 10 para obter uma descrição dessas configurações.
Quadro 9
| Exubera (insulina humana [origem do rDNA]) O pó para inalação está disponível da seguinte forma: | ||
|---|---|---|
| Descrição | Conteúdo | NDC |
| Exubera KIT | 1 inalador Exubera 1 câmara de substituição 1 mg x 180 blisters 3 mg x 90 blisters 2 Exubera® Unidades de liberação |
0069-0050-85 |
| Pacote de combinação Exubera 12 | 1 mg x 90 blisters 3 mg x 90 blisters 2 Exubera® Unidades de liberação |
0069-0050-19 |
| Pacote de combinação Exubera 15 | 1 mg x 180 blisters 3 mg x 90 blisters 2 Exubera® Unidades de liberação |
0069-0050-53 |
| Exubera 1 mg, embalagem do paciente | 90 x 1 mg 2 Exubera® Unidades de liberação |
0069-0707-37 |
| Exubera 3 mg, embalagem do paciente | 90 × 3 mg 2 Exubera® Unidades de liberação |
0069-0724-37 |
Quadro 10
| Exubera® O inalador e os componentes estão disponíveis da seguinte maneira: | ||
|---|---|---|
| Descrição | Conteúdo | NDC |
| Exubera® Inalador e Câmara | 1 Exubera® Inalador 1 câmara de substituição |
0069-0054-19 |
| Exubera® Unidades de liberação | 2 Exubera® Unidades de liberação | 0069-0097-41 |
| Exubera® Câmara | 1 câmara de substituição | 0069-0061-19 |
Armazenamento em Blister
Não em uso (fechado): Armazenar em temperatura ambiente controlada, 25 ° C (77 ° F); excursões permitidas a 15-30 ° C (59-86 ° F) [consulte Temperatura ambiente controlada pela USP]. Não congele. Não refrigerar.
Em uso: Uma vez aberto o invólucro, as bolhas de dose unitária devem ser protegidas da umidade, armazenadas a 25 ° C; excursões permitidas a 15-30 ° C (59-86 ° F) [consulte Temperatura ambiente controlada pela USP]. Não congele. Não refrigerar. Os blisters de dose unitária devem ser usados dentro de 3 meses após a abertura do invólucro laminado. Volte a colocar as bolhas no invólucro para proteger da umidade. Cuidados adicionais devem ser tomados para evitar ambientes úmidos, p. banheiro cheio de vapor após o banho.
Descarte o blister se congelado.
Armazenamento do inalador
Armazenar em temperatura ambiente controlada, 25 ° C (77 ° F); excursões permitidas a 15-30 ° C (59-86 ° F) [consulte Temperatura ambiente controlada pela USP]. Não congele. Não refrigerar.
O Exubera® O inalador pode ser usado por até 1 ano a partir da data do primeiro uso.
Substituindo o Exubera® Unidade de Liberação
O Exubera® Unidade de liberação no Exubera® O inalador deve ser trocado a cada 2 semanas.
Mantenha fora do alcance de crianças
Apenas Rx

LAB-0331-12.0
última revisão 04/2008
Exubera, insulina humana [origem do rDNA] Informações do paciente (Em inglês simples)
Informações detalhadas sobre sinais, sintomas, causas, tratamentos da diabetes
As informações desta monografia não se destinam a cobrir todos os usos possíveis, instruções, precauções, interações medicamentosas ou efeitos adversos. Esta informação é generalizada e não se destina a aconselhamento médico específico. Se você tiver dúvidas sobre os medicamentos que está tomando ou quiser obter mais informações, consulte seu médico, farmacêutico ou enfermeiro.
de volta a: Procurar todos os medicamentos para diabetes



