NovoLog para tratamento de diabetes
Marca: NovoLog
Nome genérico: insulina aspart
Forma de dosagem: injeção
Conteúdo:
Indicações e uso
Dosagem e Administração
Formas e dosagens de dosagem
Contra-indicações
Avisos e Precauções
Reações adversas
Interações medicamentosas
Uso em populações específicas
Sobredosagem
Descrição
Farmacologia Clínica
Toxicologia Não Clínica
Estudos clínicos
Como Fornecido / Armazenamento e Manuseio
NovoLog, insulina aspártico, informações para o paciente (Em inglês simples)
Indicações e uso
Tratamento de diabetes mellitus
NovoLog é um análogo da insulina indicado para melhorar o controle glicêmico em adultos e crianças com diabetes mellitus.
topo
Dosagem e Administração
Dosagem
NovoLog é um análogo da insulina com início de ação mais precoce do que a insulina humana comum. A dosagem de NovoLog deve ser individualizada. O NovoLog administrado por injeção subcutânea geralmente deve ser usado em regimes com insulina de ação intermediária ou de longa duração [ver Avisos e Precauções, Como Fornecido / Armazenamento e Manuseio]. A necessidade diária total de insulina pode variar e geralmente varia entre 0,5 e 1,0 unidades / kg / dia. Quando usado em um regime de tratamento por injeção subcutânea relacionado à refeição, 50 a 70% do total de insulina os requisitos podem ser fornecidos pela NovoLog eo restante fornecido por uma empresa de ação intermediária ou insulina de ação prolongada. Devido ao início relativamente rápido do NovoLog e à curta duração da atividade de redução da glicose, alguns pacientes podem precisar de mais insulina basal e mais insulina total para prevenir a hiperglicemia pré-refeição ao usar NovoLog do que ao uso humano regular insulina.
Não use NovoLog que seja viscoso (espessado) ou turvo; use somente se for claro e incolor. NovoLog não deve ser usado após a data de validade impressa.
Injeção subcutânea
NovoLog deve ser administrado por injeção subcutânea na região abdominal, nádegas, coxa ou parte superior do braço. Como o NovoLog tem um início mais rápido e uma duração de atividade mais curta que a insulina normal humana, ela deve ser injetada imediatamente (dentro de 5 a 10 minutos) antes de uma refeição. Os locais de injeção devem ser rotacionados na mesma região para reduzir o risco de lipodistrofia. Tal como acontece com todas as insulinas, a duração da ação de NovoLog varia de acordo com a dose, local da injeção, fluxo sanguíneo, temperatura e nível de atividade física.
NovoLog pode ser diluído com meio de diluição de insulina para NovoLog para injeção subcutânea. A diluição de uma parte de NovoLog para nove partes de diluente produzirá uma concentração de um décimo da NovoLog (equivalente ao U-10). A diluição de uma parte de NovoLog em uma parte de diluente produzirá uma concentração pela metade da do NovoLog (equivalente ao U-50).
Infusão subcutânea contínua de insulina (CSII) por bomba externa
O NovoLog também pode ser administrado por via subcutânea por uma bomba de insulina externa [ver Avisos e Precauções, Como Fornecido / Armazenamento e Manuseio]. A insulina diluída não deve ser usada em bombas externas de insulina. Como o NovoLog tem um início mais rápido e uma duração de atividade mais curta que a insulina normal humana, os bolus pré-refeição do NovoLog devem ser administrados imediatamente (dentro de 5 a 10 minutos) antes da refeição. Os locais de infusão devem ser rotacionados na mesma região para reduzir o risco de lipodistrofia. A programação inicial da bomba de infusão de insulina externa deve ser baseada na dose diária total de insulina do regime anterior. Embora exista uma variabilidade significativa entre pacientes, aproximadamente 50% da dose total é geralmente administrada em bolus de NovoLog relacionados à refeição e o restante é administrado em infusão basal. Troque o NovoLog no reservatório, os conjuntos de infusão e o local de inserção do conjunto de infusão pelo menos a cada 48 horas.
Uso intravenoso
O NovoLog pode ser administrado por via intravenosa, sob supervisão médica, para controle glicêmico, com monitoramento rigoroso dos níveis de glicose e potássio no sangue, para evitar hipoglicemia e hipocalemia [ver Avisos e Precauções, Como Fornecido / Armazenamento e Manuseio]. Para uso intravenoso, NovoLog deve ser usado em concentrações de 0,05 U / mL a 1,0 U / mL de insulina aspártico em sistemas de infusão usando bolsas de infusão de polipropileno. Foi demonstrado que NovoLog é estável em fluidos para infusão, como cloreto de sódio a 0,9%.
Inspecione NovoLog quanto a partículas e descoloração antes da administração parenteral.
topo
Formas e dosagens de dosagem
NovoLog está disponível nos seguintes tamanhos de embalagem: cada apresentação contém 100 unidades de insulina aspártico por mL (U-100).
- Frascos de 10 mL
- Cartuchos PenFill de 3 ml para o dispositivo de entrega de cartuchos PenFill de 3 ml (com ou sem a adição de um NovoPen® 3 PenMate®) com agulhas descartáveis NovoFine®
- Seringa pré-cheia NovoLog FlexPen de 3 mL
topo
Contra-indicações
NovoLog está contra-indicado
- durante episódios de hipoglicemia
- em pacientes com hipersensibilidade ao NovoLog ou a um de seus excipientes.
topo
Avisos e Precauções
Administração
NovoLog tem um início de ação mais rápido e menor duração de atividade que a insulina humana comum. Uma injeção de NovoLog deve ser seguida imediatamente por uma refeição dentro de 5 a 10 minutos. Devido à curta duração da ação da NovoLog, uma insulina de ação mais prolongada também deve ser usada em pacientes com diabetes tipo 1 e também pode ser necessária em pacientes com diabetes tipo 2. O monitoramento da glicose é recomendado para todos os pacientes com diabetes e é particularmente importante para pacientes em uso de terapia de infusão com bomba externa.
Qualquer alteração na dose de insulina deve ser feita com cautela e somente sob supervisão médica. Mudar de um produto de insulina para outro ou alterar a força da insulina pode resultar na necessidade de uma mudança na dosagem. Como com todas as preparações de insulina, o tempo de ação da NovoLog pode variar em diferentes indivíduos ou em diferentes momentos no mesmo indivíduo e depende de muitas condições, incluindo o local da injeção, o suprimento sanguíneo local, a temperatura e a atividade física. Pacientes que alteram seu nível de atividade física ou plano de refeições podem precisar de ajustes nas dosagens de insulina. Os requisitos de insulina podem ser alterados durante doenças, distúrbios emocionais ou outros estresses.
Os pacientes que usam terapia com bomba subcutânea contínua de infusão de insulina devem ser treinados para administrar insulina por injeção e ter insulina alternativa disponível em caso de falha da bomba.
Hipoglicemia
A hipoglicemia é o efeito adverso mais comum de todas as terapias com insulina, incluindo NovoLog. A hipoglicemia grave pode levar à inconsciência e / ou convulsões e resultar em comprometimento temporário ou permanente da função cerebral ou da morte. Hipoglicemia grave que requer a assistência de outra pessoa e / ou infusão parenteral de glicose ou administração de glucagon foi observada em ensaios clínicos com insulina, incluindo ensaios com NovoLog.
O momento da hipoglicemia geralmente reflete o perfil de ação no tempo das formulações de insulina administradas [ver Farmacologia Clincal]. Outros fatores como alterações na ingestão de alimentos (por exemplo, quantidade de refeições ou horário das refeições), local da injeção, exercício e medicamentos concomitantes também podem alterar o risco de hipoglicemia [ver Interações medicamentosas]. Como com todas as insulinas, tenha cuidado em pacientes com desconhecimento da hipoglicemia e em pacientes que podem estar predispostos à hipoglicemia (por exemplo, pacientes em jejum ou com ingestão irregular de alimentos). A capacidade do paciente de se concentrar e reagir pode ser prejudicada como resultado da hipoglicemia. Isso pode representar um risco em situações em que essas habilidades são especialmente importantes, como dirigir ou operar outras máquinas.
Mudanças rápidas nos níveis séricos de glicose podem induzir sintomas de hipoglicemia em pessoas com diabetes, independentemente do valor da glicose. Os sintomas de alerta precoce da hipoglicemia podem ser diferentes ou menos pronunciados sob certas condições, como diabetes de longa data, doença do nervo diabético, uso de medicamentos como betabloqueadores ou diabetes intensificada controle [ver Interações medicamentosas]. Essas situações podem resultar em hipoglicemia grave (e, possivelmente, perda de consciência) antes da conscientização do paciente sobre hipoglicemia. A insulina administrada por via intravenosa tem um início de ação mais rápido do que a insulina administrada por via subcutânea, exigindo monitoramento mais próximo da hipoglicemia.
Hipocalemia
Todos os produtos de insulina, incluindo NovoLog, causam uma mudança no potássio do espaço extracelular para o intracelular, possivelmente levando a hipocalemia que, se não tratada, pode causar paralisia respiratória, arritmia ventricular e morte. Tenha cuidado em pacientes que podem estar em risco de hipocalemia (por exemplo, pacientes que usam medicamentos para baixar o potássio, pacientes tomar medicamentos sensíveis às concentrações séricas de potássio e pacientes que recebem administração intravenosa insulina).
Insuficiência renal
Tal como acontece com outras insulinas, os requisitos de dose de NovoLog podem ser reduzidos em doentes com compromisso renal [ver Farmacologia Clínica].
Compromisso hepático
Tal como acontece com outras insulinas, os requisitos de dose de NovoLog podem ser reduzidos em doentes com compromisso hepático [ver Farmacologia Clínica].
Hipersensibilidade e reações alérgicas
Reações locais - Assim como ocorre com outras insulinas, os pacientes podem apresentar vermelhidão, inchaço ou coceira no local da injeção de NovoLog. Essas reações geralmente desaparecem em alguns dias a algumas semanas, mas em algumas ocasiões, pode exigir a descontinuação do NovoLog. Em alguns casos, essas reações podem estar relacionadas a outros fatores além da insulina, como irritantes em um agente de limpeza da pele ou má técnica de injeção. Foram relatadas reações localizadas e mialgias generalizadas com metacresol injetado, que é um excipiente no NovoLog.
Reações sistêmicas - Alergia generalizada, grave e com risco de vida, incluindo anafilaxia, pode ocorrer com qualquer produto à insulina, incluindo NovoLog. Reações anafiláticas com NovoLog foram relatadas após aprovação. Alergia generalizada à insulina também pode causar erupção cutânea no corpo todo (incluindo prurido), dispnéia, chiado no peito, hipotensão, taquicardia ou diaforese. Em ensaios clínicos controlados, foram relatadas reações alérgicas em 3 de 735 pacientes (0,4%) tratados com insulina humana regular e 10 de 1394 pacientes (0,7%) tratados com NovoLog. Em ensaios clínicos controlados e não controlados, 3 de 2341 (0,1%) pacientes tratados com NovoLog descontinuaram devido a reações alérgicas.
Produção de anticorpos
Foram observados aumentos nos títulos de anticorpos anti-insulina que reagem com insulina humana e insulina aspártico em pacientes tratados com NovoLog. Aumentos nos anticorpos anti-insulina são observados com mais freqüência com NovoLog do que com insulina humana comum. Os dados de um estudo controlado de 12 meses em pacientes com diabetes tipo 1 sugerem que o aumento desses anticorpos é transitório e as diferenças nos níveis de anticorpos entre os grupos de tratamento regular com insulina humana e insulina aspártico observados em 3 e 6 meses não eram mais evidentes em 12 meses. O significado clínico desses anticorpos não é conhecido. Esses anticorpos não parecem causar deterioração no controle glicêmico ou requerem aumentos na dose de insulina.
Mistura de Insulinas
- A mistura de NovoLog com insulina humana NPH imediatamente antes da injeção atenua o pico de concentração de NovoLog, sem afetar significativamente o tempo para atingir o pico de concentração ou a biodisponibilidade total de NovoLog. Se NovoLog for misturado com insulina humana NPH, NovoLog deve ser aspirado primeiro para a seringa e a mistura deve ser injetada imediatamente após a mistura.
- A eficácia e segurança da mistura de NovoLog com preparações de insulina produzidas por outros fabricantes não foram estudadas.
- As misturas de insulina não devem ser administradas por via intravenosa.
Infusão subcutânea contínua de insulina por bomba externa
Quando usado em uma bomba subcutânea de infusão de insulina externa, NovoLog não deve ser misturado com qualquer outra insulina ou diluente. Ao usar o NovoLog em uma bomba de insulina externa, as informações específicas do NovoLog devem ser seguidas (por exemplo, tempo de uso, frequência de troca dos conjuntos de infusão), porque as informações específicas da NovoLog podem diferir do manual geral da bomba instruções.
O mau funcionamento da bomba ou do conjunto de infusão ou a degradação da insulina podem levar a um rápido início de hiperglicemia e cetose devido ao pequeno depósito subcutâneo de insulina. Isso é especialmente pertinente para os análogos de insulina de ação rápida, que são absorvidos mais rapidamente pela pele e têm menor duração de ação. É necessária a rápida identificação e correção da causa da hiperglicemia ou cetose. Pode ser necessária terapia temporária com injeção subcutânea [ver Dosagem e Administração, Avisos e Precauçõese Como Fornecido / Armazenamento e Manuseio].
O NovoLog é recomendado para uso em sistemas de bombas adequados para infusão de insulina, conforme listado abaixo.
Bombas:
MiniMed série 500 e outras bombas equivalentes.
Reservatórios e conjuntos de infusão:
O NovoLog é recomendado para uso em reservatórios e conjuntos de infusão compatíveis com insulina e a bomba específica. Estudos in vitro demonstraram que o mau funcionamento da bomba, perda de metacresol e degradação da insulina podem ocorrer quando o NovoLog é mantido em um sistema de bomba por mais de 48 horas. Reservatórios e conjuntos de infusão devem ser trocados pelo menos a cada 48 horas.
O NovoLog não deve ser exposto a temperaturas superiores a 37 ° C (98,6 ° F). O NovoLog que será usado em uma bomba não deve ser misturado com outra insulina ou com um diluente [consulte Dosagem e Administração, Avisos e Precauçõese Como Fornecido / Armazenamento e Manuseio].
topo
Reações adversas
Experiência em ensaios clínicos
Como os ensaios clínicos são conduzidos sob modelos muito variados, as taxas de reação adversa relatadas em um ensaio clínico podem não pode ser facilmente comparado às taxas relatadas em outro ensaio clínico e pode não refletir as taxas realmente observadas em prática.
- Hipoglicemia
A hipoglicemia é a reação adversa mais comumente observada em pacientes em uso de insulina, incluindo NovoLog [ver Avisos e Precauções].
- Iniciação à insulina e intensificação do controle da glicose
A intensificação ou a rápida melhoria no controle da glicose foram associadas a um transitório, reversível distúrbio oftalmológico de refração, agravamento da retinopatia diabética e dor aguda periférica neuropatia. No entanto, o controle glicêmico a longo prazo diminui o risco de retinopatia diabética e neuropatia.
- Lipodistrofia
O uso prolongado de insulina, incluindo NovoLog, pode causar lipodistrofia no local de repetidas injeções ou infusão de insulina. A lipodistrofia inclui lipo-hipertrofia (espessamento do tecido adiposo) e lipoatrofia (afinamento do tecido adiposo) e pode afetar a absorção de insulina. Gire os locais de injeção ou infusão de insulina na mesma região para reduzir o risco de lipodistrofia.
- Ganho de peso
O ganho de peso pode ocorrer com algumas terapias com insulina, incluindo NovoLog, e tem sido atribuído aos efeitos anabólicos da insulina e à diminuição da glicosúria.
- Edema periférico
A insulina pode causar retenção de sódio e edema, principalmente se o controle metabólico anteriormente ruim for melhorado pela terapia intensiva com insulina.
- Frequências de reações adversas a medicamentos
As frequências de reações adversas a medicamentos durante os ensaios clínicos da NovoLog em pacientes com diabetes mellitus tipo 1 e diabetes mellitus tipo 2 estão listadas nas tabelas abaixo.
Tabela 1: Eventos adversos emergentes do tratamento em pacientes com diabetes mellitus tipo 1 (eventos adversos com frequência> 5% e ocorrendo mais frequentemente com NovoLog em comparação com insulina normal humana. listado)
|
NovoLog + NPH N = 596 |
Insulina regular humana + NPH N = 286 |
|||
| Termo preferido | N | (%) | N | (%) |
| Hipoglicemia * | 448 | 75% | 205 | 72% |
| Dor de cabeça | 70 | 12% | 28 | 10% |
| Lesão acidental | 65 | 11% | 29 | 10% |
| Náusea | 43 | 7% | 13 | 5% |
| Diarréia | 28 | 5% | 9 | 3% |
* Hipoglicemia é definida como um episódio de concentração de glicose no sangue
Tabela 2: Eventos adversos emergentes do tratamento em pacientes com diabetes mellitus tipo 2 (exceto hipoglicemia, efeitos adversos com frequência> 5% e que ocorrem mais frequentemente com NovoLog em comparação com insulina humana normal são listado)
|
NovoLog + NPH N = 91 |
Insulina regular humana + NPH N = 91 |
|||
| N | (%) | N | (%) | |
| Hipoglicemia* | 25 | 27% | 33 | 36% |
| Hiporreflexia | 10 | 11% | 6 | 7% |
| Onicomicose | 9 | 10% | 5 | 5% |
| Perturbação sensorial | 8 | 9% | 6 | 7% |
| Infecção do trato urinário | 7 | 8% | 6 | 7% |
| Dor no peito | 5 | 5% | 3 | 3% |
| Dor de cabeça | 5 | 5% | 3 | 3% |
| Doença de Pele | 5 | 5% | 2 | 2% |
| Dor abdominal | 5 | 5% | 1 | 1% |
| Sinusite | 5 | 5% | 1 | 1% |
* Hipoglicemia é definida como um episódio de concentração de glicose no sangue
Dados pós-marketing
As seguintes reações adversas adicionais foram identificadas durante o uso pós-aprovação de NovoLog. Como essas reações adversas são relatadas voluntariamente em uma população de tamanho incerto, geralmente não é possível estimar com segurança sua frequência. Erros de medicação nos quais outras insulinas foram acidentalmente substituídas por NovoLog foram identificados durante o uso pós-aprovação.
topo
Interações medicamentosas
Várias substâncias afetam o metabolismo da glicose e podem exigir ajuste da dose de insulina e monitoramento particularmente próximo.
- A seguir, exemplos de substâncias que podem aumentar o efeito de redução da glicose no sangue e a suscetibilidade à hipoglicemia: produtos antidiabéticos orais, pramlintida, ECA inibidores, disopiramida, fibratos, fluoxetina, inibidores da monoamina oxidase (MAO), propoxifeno, salicilatos, análogo da somatostatina (por exemplo, octreotida), sulfonamida antibióticos.
- A seguir, exemplos de substâncias que podem reduzir o efeito de redução da glicose no sangue: corticosteróides, niacina, danazol, diuréticos, agentes simpatomiméticos (por exemplo, epinefrina, salbutamol, terbutalina), isoniazida, derivados da fenotiazina, somatropina, hormônios da tireóide, estrógenos, progestágenos (por exemplo, em contraceptivos orais), atípicos antipsicóticos.
- Betabloqueadores, clonidina, sais de lítio e álcool podem potencializar ou enfraquecer o efeito da insulina na redução da glicose no sangue.
- A pentamidina pode causar hipoglicemia, que às vezes pode ser seguida por hiperglicemia.
- Os sinais de hipoglicemia podem ser reduzidos ou ausentes em pacientes que tomam produtos simpatolíticos, como betabloqueadores, clonidina, guanetidina e reserpina.
topo
Uso em populações específicas
Gravidez
Categoria B da gravidez Todas as gestações têm um risco de defeitos congênitos, perda ou outro resultado adverso, independentemente da exposição ao medicamento. Esse risco de fundo é aumentado em gestações complicadas por hiperglicemia e pode ser diminuído com um bom controle metabólico. É essencial que pacientes com diabetes ou histórico de diabetes gestacional mantenham um bom controle metabólico antes da concepção e durante a gravidez. As necessidades de insulina podem diminuir durante o primeiro trimestre, geralmente aumentar durante o segundo e o terceiro trimestres e diminuir rapidamente após o parto. O monitoramento cuidadoso do controle da glicose é essencial nesses pacientes. Portanto, as pacientes do sexo feminino devem ser avisadas ao médico se pretendem engravidar ou se engravidam enquanto tomam NovoLog.
Um estudo randomizado e aberto comparou a segurança e eficácia de NovoLog (n = 157) versus insulina humana normal (n = 165) em 322 mulheres grávidas com diabetes tipo 1. Dois terços das pacientes inscritas já estavam grávidas quando entraram no estudo. Como apenas um terço dos pacientes se matriculou antes da concepção, o estudo não foi grande o suficiente para avaliar o risco de malformações congênitas. Ambos os grupos alcançaram uma HbA1c média de ~ 6% durante a gravidez, e não houve diferença significativa na incidência de hipoglicemia materna.
Estudos de reprodução subcutânea e teratologia foram realizados com NovoLog e insulina humana regular em ratos e coelhos. Nestes estudos, NovoLog foi administrado a ratos fêmeas antes do acasalamento, durante o acasalamento e durante a gravidez e a coelhos durante a organogênese. Os efeitos do NovoLog não diferiram dos observados com insulina humana regular subcutânea. O NovoLog, como a insulina humana, causou perdas pré e pós-implantação e anormalidades viscerais / esqueléticas em ratos na dose de 200 U / kg / dia (aproximadamente 32 vezes a dose subcutânea humana dose de 1,0 U / kg / dia, com base na área U / superfície corporal) e em coelhos na dose de 10 U / kg / dia (aproximadamente três vezes a dose subcutânea humana de 1,0 U / kg / dia, com base na U / superfície corporal área). Os efeitos são provavelmente secundários à hipoglicemia materna em altas doses. Não foram observados efeitos significativos em ratos na dose de 50 U / kg / dia e em coelhos na dose de 3 U / kg / dia. Estas doses são aproximadamente 8 vezes a dose subcutânea humana de 1,0 U / kg / dia para ratos e igual à dose subcutânea humana de 1,0 U / kg / dia para coelhos, com base na área U / superfície corporal.
Mães que amamentam
Não se sabe se a insulina aspártico é excretada no leite humano. O uso de NovoLog é compatível com a amamentação, mas mulheres com diabetes que estão amamentando podem exigir ajustes nas doses de insulina.
Uso pediátrico
O NovoLog está aprovado para uso em crianças para injeções diárias subcutâneas e para infusão contínua subcutânea por bomba de insulina externa. Consulte a seção ESTUDOS CLÍNICOS para resumos de estudos clínicos.
Uso Geriátrico
Do número total de pacientes (n = 1.375) tratados com NovoLog em 3 estudos clínicos controlados, 2,6% (n = 36) tinham 65 anos ou mais. Metade desses pacientes tinha diabetes tipo 1 (18/1285) e a outra metade tinha diabetes tipo 2 (18/90). A resposta da HbA1c ao NovoLog, em comparação com a insulina humana, não diferiu por idade, principalmente em pacientes com diabetes tipo 2. Estudos adicionais em populações maiores de pacientes com 65 anos ou mais são necessários para permitir conclusões sobre a segurança de NovoLog em idosos em comparação com pacientes mais jovens. Não foram realizados estudos farmacocinéticos / farmacodinâmicos para avaliar o efeito da idade no início da ação de NovoLog.
topo
Sobredosagem
A administração excessiva de insulina pode causar hipoglicemia e, principalmente quando administrada por via intravenosa, hipocalemia. Episódios leves de hipoglicemia geralmente podem ser tratados com glicose oral. Podem ser necessários ajustes na dosagem do medicamento, no padrão das refeições ou no exercício. Os episódios mais graves com coma, convulsão ou comprometimento neurológico podem ser tratados com glucagon intramuscular / subcutâneo ou glicose intravenosa concentrada. A ingestão e observação sustentadas de carboidratos podem ser necessárias, porque a hipoglicemia pode ocorrer novamente após aparente recuperação clínica. A hipocalemia deve ser corrigida adequadamente.
topo
Descrição
NovoLog (injeção de insulina aspart [origem do rDNA]) é um análogo de insulina humana de ação rápida usado para diminuir a glicose no sangue. NovoLog é homólogo da insulina humana regular, com exceção de uma única substituição do aminoácido prolina por ácido aspártico na posição B28 e é produzido por tecnologia de DNA recombinante utilizando Saccharomyces cerevisiae fermento). A insulina aspart tem a fórmula empírica C256H381N65079S6 e um peso molecular de 5825,8.

Figura 1. Fórmula estrutural da insulina aspart.
O NovoLog é uma solução estéril, aquosa, transparente e incolor, que contém insulina aspártico 100 Unidades / mL, glicerina 16 mg / mL, fenol 1,50 mg / mL, metacresol 1,72 mg / mL, zinco 19,6 mcg / mL, hidrogenofosfato dissódico di-hidratado 1,25 mg / mL e cloreto de sódio 0,58 mg / mL. O NovoLog tem um pH de 7,2-7,6. Ácido clorídrico a 10% e / ou hidróxido de sódio a 10% podem ser adicionados para ajustar o pH.
topo
Farmacologia Clínica
Mecanismo de ação
A atividade primária do NovoLog é a regulação do metabolismo da glicose. As insulinas, incluindo NovoLog, se ligam aos receptores de insulina nas células musculares e adiposas e diminuem a glicose no sangue facilitando a captação celular de glicose e inibindo simultaneamente a produção de glicose a partir do fígado.
Farmacodinâmica
Estudos em voluntários normais e pacientes com diabetes demonstraram que a administração subcutânea de NovoLog tem um início de ação mais rápido do que a insulina humana comum.
Em um estudo em pacientes com diabetes tipo 1 (n = 22), o efeito máximo de NovoLog para redução da glicose ocorreu entre 1 e 3 horas após a injeção subcutânea (ver Figura 2). A duração da ação do NovoLog é de 3 a 5 horas. O tempo de ação da insulina e análogos da insulina, como NovoLog, pode variar consideravelmente em indivíduos diferentes ou dentro do mesmo indivíduo. Os parâmetros da atividade NovoLog (tempo de início, horário de pico e duração), conforme designado na Figura 2, devem ser considerados apenas como diretrizes gerais. A taxa de absorção de insulina e o início da atividade são afetados pelo local da injeção, exercício e outras variáveis [ver Avisos e Precauções].
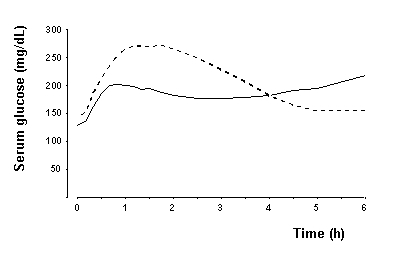
Figura 2. Glicose sérica média em série coletada até 6 horas após uma dose única de NovoLog (curva sólida) antes da refeição ou insulina humana regular (curva tracejada) injetada imediatamente antes de uma refeição em 22 pacientes com tipo 1 diabetes.
Um estudo cruzado, duplo-cego, randomizado e cruzado, em 16 pacientes com diabetes tipo 1 demonstrou que A infusão de NovoLog resultou em um perfil de glicose no sangue semelhante ao da infusão intravenosa de insulina. NovoLog ou insulina humana foi administrada até que a glicose no sangue do paciente diminuísse para 36 mg / dL ou até que o paciente demonstrou sinais de hipoglicemia (aumento da freqüência cardíaca e início da transpiração), definido como o tempo de reação autonômica (R) (veja a figura 3).
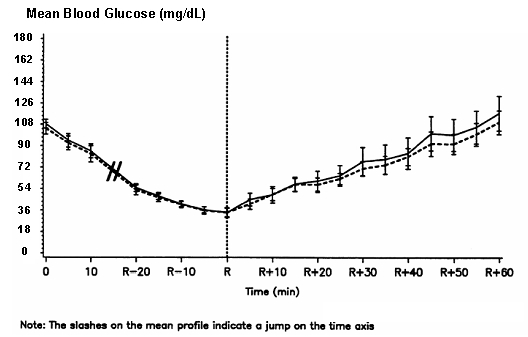
Figura 3. Glicemia sérica média em série após infusão intravenosa de NovoLog (curva tracejada) e insulina humana regular (curva sólida) em 16 pacientes com diabetes tipo 1. R representa o tempo de reação autonômica.
Farmacocinética
A substituição única do aminoácido prolina pelo ácido aspártico na posição B28 no NovoLog reduz a tendência da molécula de formar hexâmeros, como observado com a insulina humana comum. O NovoLog é, portanto, absorvido mais rapidamente após injeção subcutânea em comparação com a insulina humana comum.
Em um estudo cruzado, randomizado, duplo-cego, 17 indivíduos caucasianos do sexo masculino saudáveis entre 18 e 40 anos de recebeu uma infusão intravenosa de NovoLog ou insulina humana regular a 1,5 mU / kg / min por 120 minutos. A depuração média de insulina foi semelhante nos dois grupos, com valores médios de 1,2 l / h / kg para o grupo NovoLog e 1,2 l / h / kg para o grupo regular de insulina humana.
Biodisponibilidade e Absorção - O NovoLog possui uma absorção mais rápida, um início de ação mais rápido e uma duração de ação mais curta que a insulina humana comum após injeção subcutânea (ver Figura 2 e Figura 4). A biodisponibilidade relativa do NovoLog em comparação com a insulina humana normal indica que as duas insulinas são absorvidas em uma extensão semelhante.
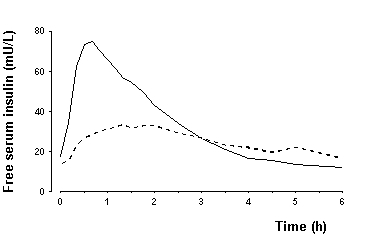
Figura 4. Concentração média sérica de insulina livre de soro coletada até 6 horas após uma dose única de NovoLog antes da refeição (curva sólida) ou insulina humana normal (curva tracejada) injetada imediatamente antes de uma refeição em 22 pacientes com tipo 1 diabetes.
Em estudos em voluntários saudáveis (total n = 10) e pacientes com diabetes tipo 1 (total n = 40), O NovoLog alcançou consistentemente picos de concentração sérica aproximadamente duas vezes mais rápido que o normal humano insulina. O tempo médio até a concentração máxima nesses ensaios foi de 40 a 50 minutos para NovoLog versus 80 a 120 minutos para insulina humana regular. Num ensaio clínico em doentes com diabetes tipo 1, NovoLog e insulina humana normal, ambos administrados por via subcutânea na dose de 0,15 U / kg de peso corporal, alcançou concentrações máximas médias de 82 e 36 mU / L, respectivamente. As características farmacocinéticas / farmacodinâmicas da insulina aspártico não foram estabelecidas em pacientes com diabetes tipo 2.
A variabilidade intra-individual no tempo até a concentração máxima de insulina no soro para voluntários masculinos saudáveis foi significativamente menor para NovoLog do que para insulina humana comum. O significado clínico desta observação não foi estabelecido.
Num estudo clínico em indivíduos não obesos saudáveis, as diferenças farmacocinéticas entre NovoLog e insulina humana descrita acima, foram observadas independentemente do local da injeção (abdome, coxa ou parte superior braço).
Distribuição e eliminação - NovoLog possui baixa ligação às proteínas plasmáticas (<10%), semelhante à observada com a insulina humana comum. Após administração subcutânea em voluntários masculinos normais (n = 24), o NovoLog foi eliminado mais rapidamente do que insulina humana normal, com uma meia-vida aparente média de 81 minutos em comparação com 141 minutos no caso humano regular insulina.
Populações específicas
Crianças e adolescentes - Foram avaliadas as propriedades farmacocinéticas e farmacodinâmicas do NovoLog e da insulina humana regular em um estudo de dose única em 18 crianças (6 a 12 anos, n = 9) e adolescentes (13 a 17 anos [Tanner grade> 2], n = 9) com tipo 1 diabetes. As diferenças relativas na farmacocinética e farmacodinâmica em crianças e adolescentes com diabetes tipo 1 entre NovoLog e insulina humana regular foram semelhantes aos de indivíduos adultos saudáveis e adultos com tipo 1 diabetes.
Sexo - Em voluntários saudáveis, nenhuma diferença nos níveis de insulina aspart foi observada entre homens e mulheres quando as diferenças de peso corporal foram levadas em consideração. Não houve diferença significativa na eficácia observada (avaliada pelo HbAlc) entre os sexos em um estudo em pacientes com diabetes tipo 1.
Obesidade - Uma dose subcutânea única de 0,1 U / kg NovoLog foi administrada em um estudo de 23 pacientes com diabetes tipo 1 e uma ampla faixa de índice de massa corporal (IMC, 22-39 kg / m2). Os parâmetros farmacocinéticos, AUC e Cmax, do NovoLog geralmente não foram afetados pelo IMC nos diferentes grupos - IMC 19-23 kg / m2 (N = 4); IMC 23-27 kg / m2 (N = 7); IMC 27-32 kg / m2 (N = 6) e IMC> 32 kg / m2 (N = 6). A depuração do NovoLog foi reduzida em 28% em pacientes com IMC> 32 kg / m2 em comparação com pacientes com IMC
Compromisso renal - Alguns estudos com insulina humana mostraram níveis aumentados de insulina na circulação em pacientes com insuficiência renal. Uma dose subcutânea única de 0,08 U / kg de NovoLog foi administrada em um estudo a indivíduos com depuração de creatinina normal (N = 6) (CLcr) (> 80 ml / min) ou leve (N = 7; CLcr = 50-80 ml / min), moderado (N = 3; CLcr = 30-50 ml / min) ou grave (mas não requer hemodiálise) (N = 2; CLcr = Avisos e precauções].
Insuficiência hepática - Alguns estudos com insulina humana mostraram níveis aumentados de insulina na circulação em pacientes com insuficiência hepática. Uma dose subcutânea única de 0,06 U / kg de NovoLog foi administrada em um estudo aberto de dose única de 24 indivíduos (N = 6 / grupo) com diferentes grau de comprometimento hepático (leve, moderado e grave) com Escores de Child-Pugh variando de 0 (voluntários saudáveis) a 12 (comprometimento hepático grave) imparidade). Neste pequeno estudo, não houve correlação entre o grau de insuficiência hepática e qualquer parâmetro farmacocinético da NovoLog. Pode ser necessário um monitoramento cuidadoso da glicose e ajustes de dose de insulina, incluindo NovoLog, em pacientes com disfunção hepática [ver Avisos e Precauções].
O efeito da idade, origem étnica, gravidez e tabagismo na farmacocinética e farmacodinâmica do NovoLog não foi estudado.
topo
Toxicologia Não Clínica
Carcinogênese, mutagênese, comprometimento da fertilidade
Não foram realizados estudos padrão de carcinogenicidade em 2 anos em animais para avaliar o potencial carcinogênico de NovoLog. Em estudos de 52 semanas, ratos Sprague-Dawley foram doseados por via subcutânea com NovoLog a 10, 50 e 200 U / kg / dia (aproximadamente 2, 8 e 32 vezes a dose subcutânea humana de 1,0 U / kg / dia, com base na área U / superfície corporal, respectivamente). Na dose de 200 U / kg / dia, NovoLog aumentou a incidência de tumores da glândula mamária em mulheres, quando comparado aos controles não tratados. A incidência de tumores mamários no NovoLog não foi significativamente diferente da insulina humana comum. A relevância desses achados para os humanos não é conhecida. O NovoLog não foi genotóxico nos seguintes testes: teste de Ames, teste de mutação genética para frente de células de linfoma de camundongo, periférico humano teste de aberração cromossômica de linfócitos no sangue, teste de micronúcleo in vivo em camundongos e teste UDS ex vivo em fígado de rato hepatócitos. Em estudos de fertilidade em ratos machos e fêmeas, em doses subcutâneas de até 200 U / kg / dia (aproximadamente 32 vezes a dose subcutânea humana, com base na área U / superfície corporal), não foram observados efeitos adversos diretos na fertilidade masculina e feminina ou no desempenho reprodutivo geral dos animais. observado.
Toxicologia Animal e / ou Farmacologia
Em ensaios biológicos padrão em camundongos e coelhos, uma unidade de NovoLog tem o mesmo efeito de redução de glicose que uma unidade de insulina humana comum. Nos seres humanos, o efeito de NovoLog é mais rápido no início e de menor duração, em comparação com a insulina humana normal, devido à sua absorção mais rápida após injeção subcutânea (consulte a Seção FARMACOLOGIA CLÍNICA Figura 2 e Figura 4).
topo
Estudos clínicos
Injeções diárias subcutâneas
Dois estudos abertos, de seis meses, controlados por ativos foram conduzidos para comparar a segurança e a eficácia do NovoLog com o Novolin R em pacientes adultos com diabetes tipo 1. Como os dois desenhos e resultados do estudo foram semelhantes, os dados são mostrados para apenas um estudo (consulte a Tabela 3). NovoLog foi administrado por injeção subcutânea imediatamente antes das refeições e insulina humana regular foi administrada por injeção subcutânea 30 minutos antes das refeições. A insulina NPH foi administrada como insulina basal em doses diárias únicas ou divididas. Alterações na HbA1c e taxas de incidência de hipoglicemia grave (conforme determinado pelo número de eventos que requerem intervenção de um terceiro ) foram comparáveis para os dois regimes de tratamento neste estudo (Tabela 3), bem como nos outros estudos clínicos citados neste seção. A cetoacidose diabética não foi relatada em nenhum dos estudos para adultos em nenhum dos grupos de tratamento.
Tabela 3. Administração NovoLog subcutânea na diabetes tipo 1 (24 semanas; n = 882)
| NovoLog + NPH | Novolin R + NPH | |
| N | 596 | 286 |
| HbA da linha de base1c (%)* | 7.9 ±1.1 | 8.0 ± 1.2 |
| Mudar da linha de base HbA1c (%) | -0.1 ± 0.8 | 0.0 ± 0.8 |
| Diferença de tratamento em HbA1c, Média (intervalo de confiança de 95%) | -0.2 (-0.3, -0.1) | |
| Dose basal de insulina (UI / kg / 24 horas) * | 0.7 ± 0.2 | 0.7 ± 0.2 |
| Dose de insulina no final do estudo (UI / kg / 24 horas) * | 0.7 ± 0.2 | 0.7 ± 0.2 |
| Pacientes com hipoglicemia grave (n,%) â € | 104 (17%) | 54 (19%) |
|
Peso corporal basal (kg) * Alteração de peso em relação à linha de base (kg) * |
75.3 ± 14.5 0.5 ± 3.3 |
75.9 ± 13.1 0.9 ± 2.9 |
* Valores são Média ± DP
â € ”Hipoglicemia grave refere-se a hipoglicemia associada a sintomas do sistema nervoso central e requerendo a intervençà £ o de outra pessoa ou hospitalizaçà £ o.
Um estudo de 24 semanas em grupo paralelo de crianças e adolescentes com diabetes tipo 1 (n = 283) com idades entre 6 e 18 anos anos compararam dois regimes subcutâneos de tratamento com doses múltiplas: NovoLog (n = 187) ou Novolin R (n = 96). A insulina NPH foi administrada como insulina basal. O NovoLog alcançou controle glicêmico comparável ao Novolin R, conforme medido pela alteração na HbA1c (Tabela 4) e ambos os grupos de tratamento tiveram uma incidência comparável de hipoglicemia. A administração subcutânea de NovoLog e insulina humana regular também foram comparadas em crianças com diabetes tipo 1 (n = 26) com idades entre 2 e 6 anos, com efeitos semelhantes sobre HbA1c e hipoglicemia.
Quadro 4 Administração Subcutânea Pediátrica de NovoLog em Diabetes Tipo 1 (24 semanas; n = 283)
| NovoLog + NPH | Novolin R + NPH | |
| N | 187 | 96 |
| HbA da linha de base1c (%) * | 8.3 ± 1.2 | 8.3 ± 1.3 |
| Mudar da linha de base HbA1c (%) | 0.1 ± 1.0 | 0.1 ± 1.1 |
| Diferença de tratamento em HbA1c, Média (intervalo de confiança de 95%) | 0.1 (-0.5, 0.1) | |
| Dose basal de insulina (UI / kg / 24 horas) * | 0.4 ± 0.2 | 0.6 ± 0.2 |
| Dose de insulina no final do estudo (UI / kg / 24 horas) * | 0.4 ± 0.2 | 0.7 ± 0.2 |
| Pacientes com hipoglicemia grave (n,%) â € | 11 (6%) | 9 (9%) |
| Cetoacidose diabética (n,%) | 10 (5%) | 2 (2%) |
|
Peso corporal basal (kg) * Alteração de peso em relação à linha de base (kg) * |
50.6 ± 19.6 2.7 ± 3.5 |
48.7 ± 15.8 2.4 ± 2.6 |
* Valores são Média ± DP
â € ”Hipoglicemia grave refere-se a hipoglicemia associada a sintomas do sistema nervoso central e requerendo a intervençà £ o de outra pessoa ou hospitalizaçà £ o.
Foi realizado um estudo de seis meses, aberto, controlado por ativos para comparar a segurança e a eficácia de NovoLog ao Novolin R em pacientes com diabetes tipo 2 (Tabela 5). NovoLog foi administrado por injeção subcutânea imediatamente antes das refeições e insulina humana regular foi administrada por injeção subcutânea 30 minutos antes das refeições. A insulina NPH foi administrada como insulina basal em doses diárias únicas ou divididas. As alterações no HbAlc e as taxas de hipoglicemia grave (conforme determinado pelo número de eventos que requerem intervenção de terceiros) foram comparáveis para os dois regimes de tratamento.
Quadro 5 Administração NovoLog subcutânea em Diabetes Tipo 2 (6 meses; n = 176)
| NovoLog + NPH | Novolin R + NPH | |
| N | 90 | 86 |
| HbA da linha de base1c (%) * | 8.1 ± 1.2 | 7.8 ± 1.1 |
| Mudar da linha de base HbA1c (%) | -0.3 ± 1.0 | -0.1 ± 0.8 |
| Diferença de tratamento em HbA1c, Média (intervalo de confiança de 95%) | - 0.1 (-0.4, -0.1) | |
| Dose basal de insulina (UI / kg / 24 horas) * | 0.6 ± 0.3 | 0.6 ± 0.3 |
| Dose de insulina no final do estudo (UI / kg / 24 horas) * | 0.7 ± 0.3 | 0.7 ± 0.3 |
| Pacientes com hipoglicemia grave (n,%) â € | 9 (10%) | 5 (8%) |
|
Peso corporal basal (kg) * Alteração de peso em relação à linha de base (kg) * |
88.4 ± 13.3 1.2 ± 3.0 |
85.8 ± 14.8 0.4 ± 3.1 |
* Valores são Média ± DP
â € ”Hipoglicemia grave refere-se a hipoglicemia associada a sintomas do sistema nervoso central e requerendo a intervençà £ o de outra pessoa ou hospitalizaçà £ o.
Infusão subcutânea contínua de insulina (CSII) por bomba externa
Dois estudos paralelos abertos (6 semanas [n = 29] e 16 semanas [n = 118]) compararam o NovoLog aos padrões regulares insulina humana (Velosulin) em adultos com diabetes tipo 1 que recebem uma infusão subcutânea com insulina externa bomba. Os dois regimes de tratamento tiveram alterações comparáveis na HbA1c e taxas de hipoglicemia grave.
Quadro 6 Estudo da bomba de insulina para adultos em diabetes tipo 1 (16 semanas; n = 118)
| NovoLog | Insulina humana tamponada | |
| N | 59 | 59 |
| HbA da linha de base1c (%) * | 7.3 ± 0.7 | 7.5 ± 0.8 |
| Mudar da linha de base HbA1c (%) | 0.0 ± 0.5 | 0.2 ± 0.6 |
| Diferença de tratamento em HbA1c, Média (intervalo de confiança de 95%) | 0.3 (-0.1, 0.4) | |
| Dose basal de insulina (UI / kg / 24 horas) * | 0.7 ± 0.8 | 0.6 ± 0.2 |
| Dose de insulina no final do estudo (UI / kg / 24 horas) * | 0.7 ± 0.7 | 0.6 ± 0.2 |
| Pacientes com hipoglicemia grave (n,%) â € | 1 (2%) | 2 (3%) |
|
Peso corporal basal (kg) * Alteração de peso em relação à linha de base (kg) * |
77.4 ± 16.1 0.1 ± 3.5 |
74.8 ± 13.8 -0.0 ± 1.7 |
* Valores são Média ± DP
â € ”Hipoglicemia grave refere-se a hipoglicemia associada a sintomas do sistema nervoso central e requerendo a intervençà £ o de outra pessoa ou hospitalizaçà £ o.
Um estudo randomizado, de 16 semanas, aberto, em paralelo, de crianças e adolescentes com diabetes tipo 1 (n = 298) com idades entre 4 e 18 anos anos compararam dois esquemas de infusão subcutânea administrados por bomba de insulina externa: NovoLog (n = 198) ou insulina lispro (n = 100). Esses dois tratamentos resultaram em alterações comparáveis da linha de base na HbA1c e taxas comparáveis de hipoglicemia após 16 semanas de tratamento (consulte a Tabela 7).
Quadro 7 Estudo pediátrico sobre bomba de insulina em diabetes tipo 1 (16 semanas; n = 298)
| NovoLog | Lispro | |
| N | 198 | 100 |
| HbA da linha de base1c (%) * | 8.0 ± 0.9 | 8.2 ± 0.8 |
| Mudar da linha de base HbA1c (%) | -0.1 ± 0.8 | -0.1 ± 0.7 |
| Diferença de tratamento em HbA1c, Média (intervalo de confiança de 95%) | -0.1 (-0.3, 0.1) | |
| Dose basal de insulina (UI / kg / 24 horas) * | 0.9 ± 0.3 | 0.9 ± 0.3 |
| Dose de insulina no final do estudo (UI / kg / 24 horas) * | 0.9 ± 0.2 | 0.9 ± 0.2 |
| Pacientes com hipoglicemia grave (n,%) â € | 19 (10%) | 8 (8%) |
| Cetoacidose diabética (n,%) | 1 (0.5%) | 0 (0) |
|
Peso corporal basal (kg) * Alteração de peso em relação à linha de base (kg) * |
54.1 ± 19.7 1.8 ± 2.1 |
55.5 ± 19.0 1.6 ± 2.1 |
* Valores são Média ± DP
â € ”Hipoglicemia grave refere-se a hipoglicemia associada a sintomas do sistema nervoso central e requerendo a intervençà £ o de outra pessoa ou hospitalizaçà £ o.
Um teste de design paralelo aberto de 16 semanas comparou a injeção pré-prandial de NovoLog em conjunto com Injeções de NPH ao NovoLog administradas por infusão subcutânea contínua em 127 adultos com tipo 2 diabetes. Os dois grupos de tratamento apresentaram reduções semelhantes na HbA1c e taxas de hipoglicemia grave (Tabela 8) [ver Indicações e uso, Dosagem e Administração, Avisos e Precauções e Como Fornecido / Armazenamento e Manuseio].
Quadro 8 Terapia com bomba no diabetes tipo 2 (16 semanas; n = 127)
| Bomba NovoLog | NovoLog + NPH | |
| N | 66 | 61 |
| HbA da linha de base1c (%) * | 8.2 ± 1.4 | 8.0 ± 1.1 |
| Mudar da linha de base HbA1c (%) | -0.6 ± 1.1 | -0.5 ± 0.9 |
| Diferença de tratamento em HbA1c, Média (intervalo de confiança de 95%) | 0.1 (0.4, 0.3) | |
| Dose basal de insulina (UI / kg / 24 horas) * | 0.7 ± 0.3 | 0.8 ± 0.5 |
| Dose de insulina no final do estudo (UI / kg / 24 horas) * | 0.9 ± 0.4 | 0.9 ± 0.5 |
|
Peso corporal basal (kg) * Alteração de peso em relação à linha de base (kg) * |
96.4 ± 17.0 1.7 ± 3.7 |
96.9 ± 17.9 0.7 ± 4.1 |
* Valores são Média ± DP
Administração intravenosa de NovoLog
Ver Seção Farmacologia Clínica / Farmacodinâmica.
topo
Como Fornecido / Armazenamento e Manuseio
O NovoLog está disponível nos seguintes tamanhos de embalagem: cada apresentação contém 100 Unidades de insulina aspártico por mL (U-100).
| Frascos de 10 mL | NDC 0169-7501-11 |
| Cartuchos PenFill de 3 mL * | NDC 0169-3303-12 |
| Seringa pré-cheia NovoLog FlexPen de 3 mL | NDC 0169-6339-10 |
* Os cartuchos NovoLog PenFill foram projetados para uso com os cartuchos Novo Nordisk de 3 ml PenFill compatíveis dispositivos de administração de insulina (com ou sem a adição de um NovoPen 3 PenMate) com NovoFine descartável agulhas.
Armazenamento recomendado
NovoLog não utilizado deve ser armazenado em uma geladeira entre 2 ° e 8 ° C (36 ° a 46 ° F). Não guarde no freezer ou diretamente ao lado do elemento de refrigeração do refrigerador. Não congele NovoLog e não use NovoLog se tiver sido congelado. NovoLog não deve ser arrastado para uma seringa e armazenado para uso posterior.
Frascos para injetáveis: após o uso inicial, um frasco para injetáveis pode ser mantido em temperaturas abaixo de 30 ° C (86 ° F) por até 28 dias, mas não deve ser exposto a calor ou luz solar excessiva. Os frascos abertos podem ser refrigerados.
Frascos não perfurados podem ser usados até a data de vencimento impressa na etiqueta, se estiverem armazenados em um refrigerador. Mantenha os frascos não utilizados na embalagem para que fiquem limpos e protegidos da luz.
Cartuchos PenFill ou seringas pré-cheias NovoLog FlexPen:
Depois que um cartucho ou uma seringa NovoLog FlexPen é perfurada, ele deve ser mantido em temperaturas abaixo de 30 ° C (86 ° F) por até 28 dias, mas não deve ser exposto a calor ou luz solar excessivos. Cartuchos ou seringas pré-cheias NovoLog FlexPen NÃO devem ser armazenadas no refrigerador. Mantenha todos os cartuchos PenFill® e as seringas pré-cheias descartáveis NovoLog FlexPen longe do calor e da luz solar diretos. Cartuchos PenFill não furados e seringas NovoLog FlexPen pré-cheias podem ser usadas até a data de vencimento impressa na etiqueta, se armazenadas na geladeira. Mantenha os cartuchos PenFill não utilizados e as seringas NovoLog FlexPen pré-cheias na caixa para que fiquem limpos e protegidos da luz.
Sempre remova a agulha após cada injeção e armazene o dispositivo de entrega do cartucho PenFill de 3 mL ou a seringa pré-cheia NovoLog FlexPen sem a agulha acoplada. Isso evita a contaminação e / ou infecção ou vazamento de insulina e garante uma dosagem precisa. Sempre use uma agulha nova para cada injeção para evitar contaminação.
Bomba:
O NovoLog no reservatório da bomba deve ser descartado após pelo menos a cada 48 horas de uso ou após exposição a temperaturas que excedem 37 ° C (98,6 ° F).
Resumo das condições de armazenamento:
As condições de armazenamento estão resumidas na tabela a seguir:
Quadro 9 Condições de armazenamento de frascos para injetáveis, cartuchos PenFill e seringa pré-cheia NovoLog FlexPen
|
NovoLog apresentação |
Não em uso (fechado) Temperatura ambiente (abaixo de 30 ° C) | Não em uso (fechado) Refrigerado | Em uso (aberto) Temperatura ambiente (abaixo de 30 ° C) |
| Frasco de 10 mL | 28 dias | Até a data de validade | 28 dias (refrigerado / temperatura ambiente) |
| Cartuchos PenFill de 3 mL | 28 dias | Até a data de validade |
28 dias (Não refrigerar) |
| Seringa pré-cheia NovoLog FlexPen de 3 mL | 28 dias | Até a data de validade |
28 dias (Não refrigerar) |
Armazenamento de NovoLog diluído
NovoLog diluído com meio de diluição de insulina para NovoLog para uma concentração equivalente a U-10 ou equivalente a U-50 pode permanecer em uso pelo paciente a temperaturas abaixo de 30 ° C (86 ° F) por 28 dias.
Armazenamento de NovoLog em fluidos para infusão
Os sacos de infusão preparados conforme indicado em Dosagem e administração (2) são estáveis à temperatura ambiente por 24 horas. Alguma insulina será inicialmente adsorvida no material da bolsa de infusão.
última atualização 12/2008
NovoLog, insulina aspártico, informações para o paciente (Em inglês simples)
Informações detalhadas sobre sinais, sintomas, causas, tratamentos da diabetes
As informações desta monografia não se destinam a cobrir todos os usos possíveis, instruções, precauções, interações medicamentosas ou efeitos adversos. Esta informação é generalizada e não se destina a aconselhamento médico específico. Se você tiver dúvidas sobre os medicamentos que está tomando ou quiser obter mais informações, consulte seu médico, farmacêutico ou enfermeiro.
de volta a: Procurar todos os medicamentos para diabetes


