Avandia para tratamento de diabetes
Marca: AVANDIA
Nome genérico: maleato de rosiglitazona
Conteúdo:
Indicações e uso
Dosagem e Administração
Formas e Forças de Dosagem
Contra-indicações
Avisos e Precauções
Reações adversas
Interações medicamentosas
Uso em populações específicas
Sobredosagem
Descrição
Farmacologia Clínica
Toxicologia Não Clínica
Estudos clínicos
Como fornecido
Avandia, maleato de rosiglitazona, informações ao paciente (Em inglês simples)
ATENÇÃO
FALHA CONGESTIVA DO CORAÇÃO E ISQUEMIA MIOCARDIAL
- As tiazolidinedionas, incluindo a rosiglitazona, causam ou exacerbam insuficiência cardíaca congestiva em alguns pacientes [ver AVISOS E PRECAUÇÕES]. Após o início do AVANDIA, e após o aumento da dose, observe cuidadosamente os pacientes quanto a sinais e sintomas de insuficiência cardíaca (incluindo ganho de peso excessivo e rápido, dispnéia e / ou edema). Se esses sinais e sintomas se desenvolverem, a insuficiência cardíaca deve ser gerenciada de acordo com os padrões atuais de atendimento. Além disso, deve ser considerada a descontinuação ou redução da dose de AVANDIA.
- AVANDIA não é recomendado em pacientes com insuficiência cardíaca sintomática. O início do AVANDIA em pacientes com insuficiência cardíaca classe III ou IV da NYHA estabelecida é contraindicado. [Vejo CONTRA-INDICAÇÕES e AVISOS E PRECAUÇÕES.]
- Uma metanálise de 42 estudos clínicos (duração média de 6 meses; 14.237 pacientes no total), a maioria dos quais comparou o AVANDIA ao placebo, mostrou que o AVANDIA está associado a um risco aumentado de eventos isquêmicos do miocárdio, como angina ou infarto do miocárdio. Três outros estudos (duração média de 41 meses; 14.067 pacientes no total), comparando o AVANDIA com outros antidiabéticos orais aprovados ou placebo, não confirmaram ou excluíram esse risco. Na sua totalidade, os dados disponíveis sobre o risco de isquemia do miocárdio são inconclusivos. [Vejo AVISOS E PRECAUÇÕES.]
topo
Indicações e uso
Monoterapia e terapia combinada
AVANDIA é indicado como um complemento à dieta e exercício para melhorar o controle glicêmico em adultos com diabetes mellitus tipo 2.
Limitações importantes de uso
- Devido ao seu mecanismo de ação, o AVANDIA é ativo apenas na presença de insulina endógena. Por conseguinte, AVANDIA não deve ser utilizado em doentes com diabetes mellitus tipo 1 ou no tratamento da cetoacidose diabética.
- A administração concomitante de AVANDIA e insulina não é recomendada.
- O uso de AVANDIA com nitratos não é recomendado.
topo
Dosagem e Administração
O manejo da terapia antidiabética deve ser individualizado. Todos os doentes devem iniciar o AVANDIA na dose mais baixa recomendada. Aumentos adicionais na dose de AVANDIA devem ser acompanhados por um monitoramento cuidadoso de eventos adversos relacionados à retenção de líquidos [ver Aviso em caixa e Avisos e Precauções].
AVANDIA pode ser administrado em uma dose inicial de 4 mg como uma dose diária única ou em 2 doses divididas. Para pacientes que respondem inadequadamente após 8 a 12 semanas de tratamento, conforme determinado pela redução na glicemia de jejum (FPG), a dose pode ser aumentada para 8 mg por dia em monoterapia ou em combinação com metformina, sulfonilureia ou sulfonilureia mais metformina. As reduções nos parâmetros glicêmicos por dose e regime são descritas em Estudos Clínicos. AVANDIA pode ser tomado com ou sem alimentos.
A dose diária total de AVANDIA não deve exceder 8 mg.
Monoterapia
A dose inicial usual de AVANDIA é de 4 mg, administrada em dose única uma vez ao dia ou em doses divididas duas vezes ao dia. Em ensaios clínicos, o regime de 4 mg duas vezes ao dia resultou na maior redução na FPG e na hemoglobina A1c (HbA1c).
Combinação com sulfonilureia ou metformina
Quando o AVANDIA é adicionado à terapia existente, as doses atuais do (s) agente (s) podem ser continuadas após o início da terapia com AVANDIA.
Sulfonilureia: Quando usada em combinação com sulfonilureia, a dose inicial usual de AVANDIA é de 4 mg administrada como dose única uma vez ao dia ou em doses divididas duas vezes ao dia. Se os pacientes reportarem hipoglicemia, a dose da sulfonilureia deve ser diminuída.
Metformina: A dose inicial usual de AVANDIA em combinação com metformina é de 4 mg, administrada como dose única uma vez ao dia ou em doses divididas duas vezes ao dia. É improvável que a dose de metformina exija ajuste devido à hipoglicemia durante a terapia combinada com AVANDIA.
Combinação com sulfonilureia mais metformina
A dose inicial usual de AVANDIA em combinação com uma sulfonilureia mais metformina é de 4 mg, administrada em dose única uma vez ao dia ou em doses divididas duas vezes ao dia. Se os pacientes reportarem hipoglicemia, a dose da sulfonilureia deve ser diminuída.
Populações específicas de pacientes
Insuficiência renal: Não é necessário ajuste posológico quando AVANDIA é utilizado como monoterapia em doentes com compromisso renal. Uma vez que a metformina é contra-indicada nesses pacientes, a administração concomitante de metformina e AVANDIA também é contra-indicada em pacientes com insuficiência renal.
Compromisso hepático: As enzimas hepáticas devem ser medidas antes do início do tratamento com AVANDIA. A terapêutica com AVANDIA não deve ser iniciada se o doente apresentar evidência clínica de doença hepática ou aumento dos níveis séricos de transaminase (ALT> 2,5 vezes o limite superior do normal no início da terapia). Após o início do AVANDIA, as enzimas hepáticas devem ser monitorizadas periodicamente, de acordo com o julgamento clínico do profissional de saúde. [Vejo Avisos e Precauções e FARMACOLOGIA CLÍNICA.]
Pediátrico: Os dados são insuficientes para recomendar o uso pediátrico de AVANDIA [ver USO EM POPULAÇÕES ESPECÍFICAS].
topo
Formas de dosagem e pontos fortes
O comprimido pentagonal TILTAB revestido por película contém rosiglitazona como maleato da seguinte forma:
- 2 mg - rosa, gravado com SB de um lado e 2 do outro
- 4 mg - laranja, gravado com SB de um lado e 4 do outro
- 8 mg - marrom-avermelhado, gravado com SB de um lado e 8 do outro
topo
Contra-indicações
O início do AVANDIA em pacientes com insuficiência cardíaca classe III ou IV estabelecida pela New York Heart Association (NYHA) é contra-indicado [ver AVISO EM CAIXA].
topo
Avisos e Precauções
Insuficiência Cardíaca
AVANDIA, como outras tiazolidinedionas, isoladamente ou em combinação com outros agentes antidiabéticos, pode causar retenção de líquidos, o que pode exacerbar ou levar à insuficiência cardíaca. Os pacientes devem ser observados quanto a sinais e sintomas de insuficiência cardíaca. Se esses sinais e sintomas se desenvolverem, a insuficiência cardíaca deve ser gerenciada de acordo com os padrões atuais de atendimento. Além disso, deve ser considerada a descontinuação ou redução da dose de rosiglitazona [ver AVISO EM CAIXA].
Pacientes com insuficiência cardíaca congestiva (ICC) NYHA Classe I e II tratados com AVANDIA têm um risco aumentado de eventos cardiovasculares. Foi realizado um estudo ecocardiográfico de 52 semanas, duplo-cego e controlado por placebo em 224 pacientes com diabetes tipo 2 diabetes mellitus e ICC de classe I ou II da NYHA (fração de ejeção <45%) sobre antidiabético de fundo e ICC terapia. Um comitê independente conduziu uma avaliação às cegas de eventos relacionados a líquidos (incluindo insuficiência cardíaca congestiva) e hospitalizações cardiovasculares de acordo com critérios predefinidos (adjudicação). Separadamente da adjudicação, outros eventos adversos cardiovasculares foram relatados pelos investigadores. Embora não tenha sido observada diferença de tratamento na mudança em relação às frações iniciais de ejeção, mais foram observados eventos adversos cardiovasculares após o tratamento com AVANDIA em comparação com placebo durante o Estudo de 52 semanas. (Veja a Tabela 1.)
Tabela 1. Eventos Adversos Cardiovasculares Emergentes em Pacientes com Insuficiência Cardíaca Congestiva (NYHA Classe I e II) tratados com AVANDIA ou Placebo (além de terapia antidiabética e ICC prévia)
| Eventos | AVANDIA N = 110 n (%) |
Placebo N = 114 n (%) |
| Adjudicado | ||
| Mortes cardiovasculares | 5 (5%) | 4 (4%) |
| Piora da ICC | 7 (6%) | 4 (4%) |
| - com internação noturna | 5 (5%) | 4 (4%) |
| - sem hospitalização noturna | 2 (2%) | 0 (0%) |
| Edema novo ou agravado | 28 (25%) | 10 (9%) |
| Dispnéia nova ou agravada | 29 (26%) | 19 (17%) |
| Aumentos na medicação para ICC | 36 (33%) | 20 (18%) |
| Hospitalização cardiovascular * | 21 (19%) | 15 (13%) |
| Relato do investigador, não adjudicado | ||
| Eventos adversos isquêmicos | 10 (9%) | 5 (4%) |
| - Infarto do miocárdio | 5 (5%) | 2 (2%) |
| - Angina | 6 (5%) | 3 (3%) |
| * Inclui hospitalização por qualquer motivo cardiovascular. |
O início do AVANDIA em pacientes com insuficiência cardíaca classe III ou IV da NYHA estabelecida é contraindicado. AVANDIA não é recomendado em pacientes com insuficiência cardíaca sintomática. [Vejo AVISO EM CAIXA.]
Pacientes com síndromes coronárias agudas não foram estudados em ensaios clínicos controlados. Dado o potencial de desenvolvimento de insuficiência cardíaca em pacientes com evento coronariano agudo, o início de AVANDIA não é recomendado para pacientes com evento coronariano agudo, e a descontinuação de AVANDIA durante esta fase aguda deve ser considerado.
Pacientes com status cardíaco da Classe III e IV da NYHA (com ou sem ICC) não foram estudados em ensaios clínicos controlados. AVANDIA não é recomendado em pacientes com status cardíaco das classes III e IV da NYHA.
Isquemia do miocárdio
Meta-análise de isquemia miocárdica em um grupo de 42 ensaios clínicos
Uma meta-análise foi conduzida retrospectivamente para avaliar eventos adversos cardiovasculares relatados em 42 ensaios clínicos randomizados, controlados e em dupla ocultação (duração média de 6 meses).1
Esses estudos foram realizados para avaliar a eficácia da redução da glicose no diabetes tipo 2, e a adjudicação planejada prospectivamente de eventos cardiovasculares não ocorreu nos ensaios. Alguns ensaios foram controlados por placebo e alguns usaram antidiabéticos orais ativos como controle. Os estudos controlados por placebo incluíram ensaios em monoterapia (monoterapia com AVANDIA versus monoterapia com placebo) e ensaios complementares (AVANDIA ou placebo, adicionados a sulfonilureia, metformina ou insulina). Os estudos de controle ativo incluíram ensaios em monoterapia (monoterapia com AVANDIA versus sulfonilureia ou metformina monoterapia) e ensaios complementares (AVANDIA mais sulfonilureia ou AVANDIA mais metformina, versus sulfonilureia mais metformina). Foram incluídos 14.237 pacientes (8.604 em grupos de tratamento contendo AVANDIA, 5.633 em grupos comparadores), com 4.143 pacientes-ano de exposição a AVANDIA e 2.675 pacientes-ano de exposição a comparador. Os eventos isquêmicos do miocárdio incluíram angina de peito, angina de peito agravada, angina instável, parada cardíaca, dor no peito, coronariana oclusão arterial, dispnéia, infarto do miocárdio, trombose coronária, isquemia miocárdica, doença arterial coronariana e artéria coronária transtorno. Nesta análise, um risco aumentado de isquemia do miocárdio com AVANDIA versus comparadores combinados foi observado (AVANDIA a 2% versus comparadores de 1,5%, odds ratio 1,4, intervalo de confiança de 95% [IC] 1,1, 1.8). Foi observado um risco aumentado de eventos isquêmicos do miocárdio com AVANDIA nos estudos controlados por placebo, mas não nos estudos controlados por ativos. (Veja a Figura 1.)
Foi observado um maior risco aumentado de eventos isquêmicos do miocárdio em estudos nos quais AVANDIA foi adicionado insulina (2,8% para AVANDIA mais insulina versus 1,4% para placebo mais insulina, [OR 2,1, IC95% 0,9, 5.1]). Esse risco aumentado reflete uma diferença de 3 eventos por 100 pacientes-ano (IC95% -0,1, 6,3) entre os grupos de tratamento. [Vejo AVISOS E PRECAUÇÕES.]
Figura 1. Razões florestais de probabilidades (intervalos de confiança de 95%) para eventos isquêmicos do miocárdio na metanálise de 42 ensaios clínicos

Também foi observado um maior risco aumentado de isquemia do miocárdio em pacientes que receberam AVANDIA e terapia com nitrato de fundo. Para AVANDIA (N = 361) versus controle (N = 244) em usuários de nitrato, a razão de chances foi de 2,9 (IC95% 1,4, 5,9), enquanto para os usuários não nitratos (total de cerca de 14.000 pacientes), o odds ratio foi de 1,3 (IC95% 0,9, 1.7). Esse risco aumentado representa uma diferença de 12 eventos isquêmicos do miocárdio por 100 pacientes-ano (IC95% 3,3, 21,4). A maioria dos usuários de nitrato havia estabelecido doença cardíaca coronária. Entre os pacientes com doença cardíaca coronária conhecida que não estavam em terapia com nitrato, não foi demonstrado um risco aumentado de eventos isquêmicos do miocárdio para AVANDIA versus comparador.
Eventos isquêmicos do miocárdio em grandes ensaios clínicos prospectivos randomizados de longo prazo da AVANDIA
Os dados de outros três ensaios clínicos grandes, de longo prazo, prospectivos, randomizados e controlados de AVANDIA foram avaliados separadamente da metanálise. Estes três ensaios incluem um total de 14.067 pacientes (grupos de tratamento contendo AVANDIA N = 6.311, comparador grupos N = 7.756), com exposição de 21.803 pacientes-ano para AVANDIA e 25.998 anos-paciente para comparador. A duração do acompanhamento excedeu 3 anos em cada estudo. O ADOPT (um estudo de progressão de resultados de diabetes) foi um estudo randomizado, controlado por ativos, de 4 a 6 anos, em pacientes recentemente diagnosticados com diabetes tipo 2, sem tratamento medicamentoso.
Foi um teste de eficácia e segurança geral que foi projetado para examinar a durabilidade de
AVANDIA como monoterapia (N = 1.456) para controle glicêmico no diabetes tipo 2, com braços comparadores de sulfonilureia em monoterapia (N = 1.441) e metformina em monoterapia (N = 1.454). O DREAM (Avaliação da Redução do Diabetes com Rosiglitazona e Medicamento com Ramipril, relatório publicado2) foi de 3 a Estudo randomizado, controlado por placebo, em cinco anos, em pacientes com tolerância à glicose diminuída e / ou jejum diminuído glicose. Tinha um desenho fatorial 2x2, destinado a avaliar o efeito de AVANDIA, e separadamente do ramipril (um inibidor da enzima de conversão da angiotensina [IECA]), na progressão para diabetes manifesto. No DREAM, 2.635 pacientes estavam em grupos de tratamento contendo AVANDIA e 2.634 em grupos de tratamento que não continham AVANDIA.Os resultados intermediários foram publicados 3 para RECORD (Rosiglitazona Avaliada para Resultados Cardíacos e Regulação da Glicemia em Diabetes), um estudo aberto de resultados cardiovasculares de 6 anos em aberto, em pacientes com diabetes tipo 2 com tratamento médio duração de 3,75 anos. RECORD inclui pacientes que falharam com metformina ou sulfonilureia em monoterapia; aqueles que falharam na metformina são randomizados para receber AVANDIA adicional ou sulfonilureia adicional, e aqueles que falharam na sulfonilureia são randomizados para receber o AVANDIA adicional ou o adicional metformina. No RECORD, um total de 2.220 pacientes estão recebendo AVANDIA adicional, e 2.227 pacientes estão em um dos regimes complementares que não contêm AVANDIA.
Para estes três ensaios, as análises foram realizadas utilizando um composto dos principais eventos cardiovasculares adversos (infarto do miocárdio, morte cardiovascular ou acidente vascular cerebral), referidos a seguir como MACE. Esse desfecho diferiu do amplo desfecho dos eventos isquêmicos do miocárdio da metanálise, mais da metade dos quais eram angina. O infarto do miocárdio incluiu infarto do miocárdio fatal e não fatal, mais morte súbita. Como mostrado na Figura 2, os resultados para os três pontos finais (MACE, MI e Total Mortality) não foram estatisticamente significativamente diferentes entre AVANDIA e comparadores.

Nas análises preliminares do estudo DREAM, a incidência de eventos cardiovasculares foi maior entre os indivíduos que recebeu AVANDIA em combinação com ramipril do que entre os indivíduos que receberam apenas ramipril, conforme ilustrado na Figura 2. Esse achado não foi confirmado no ADOPT e RECORD (ensaios ativos controlados em pacientes com diabetes), nos quais 30% e 40% dos pacientes, respectivamente, relataram o uso de inibidores da ECA no início do estudo.
Na sua totalidade, os dados disponíveis sobre o risco de isquemia do miocárdio são inconclusivos. Conclusões definitivas sobre esse risco aguardam a conclusão de um estudo de resultados cardiovasculares adequadamente projetado.
Não houve estudos clínicos que estabelecessem evidências conclusivas de redução de risco macrovascular com AVANDIA ou qualquer outro medicamento antidiabético oral.
Insuficiência Cardíaca Congestiva e Isquemia Miocárdica Durante a Coadministração de AVANDIA com Insulina
Nos estudos em que o AVANDIA foi adicionado à insulina, o AVANDIA aumentou o risco de insuficiência cardíaca congestiva e isquemia do miocárdio. (Veja a tabela 2.)
A administração concomitante de AVANDIA e insulina não é recomendada. [Vejo Indicações e uso e AVISOS E PRECAUÇÕES.]
Em cinco ensaios clínicos de 26 semanas, controlados, randomizados, duplo-cegos, incluídos na meta-análise [ver AVISOS E PRECAUÇÕES], pacientes com diabetes mellitus tipo 2 foram randomizados para co-administração de AVANDIA e insulina (N = 867) ou insulina (N = 663). Nestes 5 ensaios, AVANDIA foi adicionado à insulina. Esses ensaios incluíram pacientes com diabetes de longa data (duração média de 12 anos) e uma alta prevalência de doenças pré-existentes. condições médicas, incluindo neuropatia periférica, retinopatia, doença cardíaca isquêmica, doença vascular e coração congestivo fracasso. O número total de pacientes com insuficiência cardíaca congestiva emergente foi de 21 (2,4%) e 7 (1,1%) nos grupos AVANDIA mais insulina e insulina, respectivamente. O número total de pacientes com isquemia miocárdica emergente foi de 24 (2,8%) e 9 (1,4%) nos grupos AVANDIA mais insulina e insulina, respectivamente (OR 2,1 [IC95% 0,9, 5,1]). Embora a taxa de eventos para insuficiência cardíaca congestiva e isquemia miocárdica tenha sido baixa nos consistentemente, a taxa de eventos foi 2 vezes ou mais alta com a co-administração de AVANDIA e insulina. Estes eventos cardiovasculares foram observados nas doses diárias de 4 mg e 8 mg de AVANDIA. (Veja a tabela 2.)
Mesa 2. Ocorrência de eventos cardiovasculares em 5 ensaios controlados de adição de AVANDIA ao tratamento estabelecido com insulina
| Evento* | AVANDIA + Insulina (n = 867) n (%) |
Insulina (n = 663) n (%) |
| Insuficiência cardíaca congestiva | 21 (2.4%) | 7 (1.1%) |
| Isquemia do miocárdio | 24 (2.8%) | 9 (1.4%) |
| Composto de morte cardiovascular, infarto do miocárdio ou acidente vascular cerebral | 10 (1.2%) | 5 (0.8%) |
| Acidente vascular encefálico | 5 (0.6%) | 4 (0.6%) |
| Infarto do miocárdio | 4 (0.5%) | 1 (0.2%) |
| Morte cardiovascular | 4 (0.5%) | 1 (0.2%) |
| Todas as mortes | 6 (0.7%) | 1 (0.2%) |
| * Eventos não são exclusivos; isto é, um paciente com morte cardiovascular devido a um infarto do miocárdio seria contado em 4 categorias de eventos (isquemia miocárdica; morte cardiovascular, infarto do miocárdio ou acidente vascular cerebral; infarto do miocárdio; morte cardiovascular). |
Em um sexto, ensaio clínico randomizado, duplo-cego, de 24 semanas de AVANDIA e co-administração de insulina, a insulina foi adicionada ao AVANDAMET® (maleato de rosiglitazona e metformina HCl) (n = 161) e comparado à insulina mais placebo (n = 158), após um período de ocultação de 8 semanas com AVANDAMET. Pacientes com edema que requerem terapia farmacológica e pacientes com insuficiência cardíaca congestiva foram excluídos no início e durante o período inicial.
No grupo que recebeu AVANDAMET mais insulina, houve um evento isquêmico do miocárdio e uma morte súbita. Não foi observada isquemia miocárdica no grupo insulina e nenhuma insuficiência cardíaca congestiva foi relatada em nenhum dos grupos de tratamento.
Edema
AVANDIA deve ser utilizado com precaução em doentes com edema. Num estudo clínico em voluntários saudáveis que receberam 8 mg de AVANDIA uma vez por dia durante 8 semanas, houve um aumento estatisticamente significativo no volume plasmático médio em comparação ao placebo.
Como as tiazolidinedionas, incluindo a rosiglitazona, podem causar retenção de líquidos, o que pode exacerbar ou levar à insuficiência cardíaca congestiva, AVANDIA deve ser utilizado com precaução em doentes com risco de doença cardíaca fracasso. Os pacientes devem ser monitorados quanto a sinais e sintomas de insuficiência cardíaca [ver AVISO EM CAIXA, AVISOS E PRECAUÇÕES ].
Em ensaios clínicos controlados de pacientes com diabetes tipo 2, foi relatado edema leve a moderado em pacientes tratados com AVANDIA e pode estar relacionado à dose. Os pacientes com edema em andamento eram mais propensos a ter eventos adversos associados a edema se iniciados em terapia combinada com insulina e AVANDIA [ver REAÇÕES ADVERSAS].
Ganho de peso
O ganho de peso relacionado à dose foi observado apenas com AVANDIA e em combinação com outros agentes hipoglicêmicos (Tabela 3). O mecanismo de ganho de peso não é claro, mas provavelmente envolve uma combinação de retenção de líquidos e acúmulo de gordura.
Na experiência pós-comercialização, houve relatos de aumentos invulgarmente rápidos no peso e aumentos acima do geralmente observado em ensaios clínicos. Os pacientes que experimentam tais aumentos devem ser avaliados quanto a acúmulo de líquidos e eventos relacionados ao volume, como edema excessivo e insuficiência cardíaca congestiva [ver AVISO EM CAIXA].
Tabela 3. Alterações de peso (kg) da linha de base no ponto final durante os ensaios clínicos
| Monoterapia | Duração | Grupo de controle | AVANDIA 4 mg Mediana (25, 75) percentil) |
AVANDIA 8 mg Mediana (25, 75) percentil) |
|
| Mediana (25, 75) percentil) | |||||
| 26 semanas | placebo | -0.9 (-2.8, 0.9) n = 210 |
1.0 (-0.9, 3.6) n = 436 |
3.1 (1.1, 5.8) n = 439 |
|
| 52 semanas | sulfonilureia | 2.0 (0, 4.0) n = 173 |
2.0 (-0.6, 4.0) n = 150 |
2.6 (0, 5.3) n = 157 |
|
| Terapia combinada | |||||
| Sulfonilureia | 24-26 semanas | sulfonilureia | 0 (-1.0, 1.3) n = 1.155 |
2.2 (0.5, 4.0) n = 613 |
3.5 (1.4, 5.9) n = 841 |
| Metformina | 26 semanas | metformina | -1.4 (-3.2, 0.2) n = 175 |
0.8 (-1.0, 2.6) n = 100 |
2.1 (0, 4.3) n = 184 |
| Insulina | 26 semanas | insulina | 0.9 (-0.5, 2.7) n = 162 |
4.1 (1.4, 6.3) n = 164 |
5.4 (3.4, 7.3) n = 150 |
| Sulfonilureia + metformina | 26 semanas | sulfonilureia + metformina | 0.2 (-1.2, 1.6) n = 272 |
2.5 (0.8, 4.6) n = 275 |
4.5 (2.4, 7.3) n = 276 |
Em um estudo comparativo de quatro a seis anos em monoterapia (ADOPT) em pacientes recentemente diagnosticados com diabetes tipo 2 não tratados anteriormente com medicação antidiabética [ver Estudo clínicos], a alteração mediana do peso (25º, 75º percentis) da linha de base aos 4 anos foi de 3,5 kg (0,0, 8,1) para AVANDIA, 2,0 kg (-1,0, 4,8) para gliburida e -2,4 kg (-5,4, 0,5) para metformina.
Num estudo de 24 semanas em doentes pediátricos com idades entre os 10 e os 17 anos tratados com AVANDIA 4 a 8 mg por dia, um ganho de peso médio de 2,8 kg (25)º, 75º percentis: 0,0, 5,8) foi relatado.
Efeitos hepáticos
As enzimas hepáticas devem ser medidas antes do início da terapia com AVANDIA em todos os pacientes e, posteriormente, periodicamente, de acordo com o julgamento clínico do profissional de saúde. A terapêutica com AVANDIA não deve ser iniciada em doentes com níveis basais elevados de enzimas hepáticas (ALT> 2,5 vezes o limite superior do normal). Pacientes com enzimas hepáticas levemente elevadas (níveis de ALT <2,5 vezes o limite superior do normal) no início ou durante o tratamento com AVANDIA deve ser avaliado para determinar a causa da enzima hepática elevação. O início ou a continuação da terapia com AVANDIA em pacientes com elevações leves das enzimas hepáticas deve prosseguir com cautela e incluem acompanhamento clínico rigoroso, incluindo monitoramento de enzimas hepáticas, para determinar se as elevações das enzimas hepáticas se resolvem ou piorar. Se a qualquer momento os níveis de ALT aumentarem para> 3X o limite superior do normal em pacientes em terapia com AVANDIA, os níveis de enzimas hepáticas devem ser verificados novamente o mais rápido possível. Se os níveis de ALT permanecerem> 3X o limite superior do normal, a terapia com AVANDIA deve ser descontinuada.
Se algum paciente desenvolver sintomas sugestivos de disfunção hepática, que podem incluir náusea inexplicável, vômito, dor abdominal, fadiga, anorexia e / ou urina escura, as enzimas hepáticas devem ser verificadas. A decisão de continuar o paciente em terapia com AVANDIA deve ser orientada por julgamento clínico, pendente de avaliações laboratoriais. Se houver icterícia, a terapia medicamentosa deve ser descontinuada. [Vejo REAÇÕES ADVERSAS.]
Edema Macular
Foi relatado edema macular na experiência pós-comercialização em alguns pacientes diabéticos que estavam tomando AVANDIA ou outra tiazolidinediona. Alguns pacientes apresentaram visão turva ou diminuição da acuidade visual, mas alguns pacientes parecem ter sido diagnosticados no exame oftalmológico de rotina. A maioria dos pacientes apresentava edema periférico no momento do diagnóstico de edema macular. Alguns pacientes apresentaram melhora no edema macular após a descontinuação da tiazolidinediona. Pacientes com diabetes devem fazer exames oftalmológicos regulares por um oftalmologista, de acordo com os padrões de atendimento da American Diabetes Association. Além disso, qualquer diabético que relate qualquer tipo de sintoma visual deve ser imediatamente encaminhado a um oftalmologista, independentemente dos medicamentos subjacentes do paciente ou de outros achados físicos. [Vejo REAÇÕES ADVERSAS.]
Fraturas
Em um estudo comparativo de 4 a 6 anos (ADOPT) de controle glicêmico com monoterapia em pacientes sem uso de drogas recentemente diagnosticada com diabetes mellitus tipo 2, observou-se um aumento da incidência de fratura óssea em pacientes do sexo feminino AVANDIA. Durante o período de 4 a 6 anos, a incidência de fratura óssea no sexo feminino foi de 9,3% (60/645) para AVANDIA versus 3,5% (21/605) para gliburida e 5,1% (30/590) para metformina. Este aumento da incidência foi observado após o primeiro ano de tratamento e persistiu durante o curso do estudo. A maioria das fraturas nas mulheres que receberam AVANDIA ocorreu na parte superior do braço, mão e pé. Esses locais de fratura são diferentes daqueles geralmente associados à osteoporose pós-menopáusica (por exemplo, quadril ou coluna vertebral). Não foi observado aumento nas taxas de fraturas em homens tratados com AVANDIA. O risco de fratura deve ser considerado no atendimento de pacientes, principalmente do sexo feminino, tratados com AVANDIA e atenção dada à avaliação e manutenção da saúde óssea de acordo com os padrões atuais de Cuidado.
Efeitos hematológicos
Ocorreram reduções na hemoglobina média e no hematócrito de maneira relacionada à dose em pacientes adultos tratados com AVANDIA [ver REAÇÕES ADVERSAS]. As alterações observadas podem estar relacionadas ao aumento do volume plasmático observado com o tratamento com AVANDIA.
Controle de diabetes e glicose no sangue
Os pacientes que recebem AVANDIA em combinação com outros agentes hipoglicêmicos podem estar em risco de hipoglicemia, e pode ser necessária uma redução na dose do agente concomitante.
As medições periódicas de glicose no sangue em jejum e HbA1c devem ser realizadas para monitorar a resposta terapêutica.
Ovulação
A terapia com AVANDIA, como outras tiazolidinedionas, pode resultar em ovulação em algumas mulheres anovulatórias na pré-menopausa. Como resultado, esses pacientes podem estar em maior risco de gravidez enquanto tomam AVANDIA [ver Uso em populações específicas]. Assim, deve ser recomendada contracepção adequada em mulheres na pré-menopausa. Esse possível efeito não foi especificamente investigado em estudos clínicos; portanto, a frequência dessa ocorrência não é conhecida.
Embora o desequilíbrio hormonal tenha sido observado em estudos pré-clínicos [ver Toxicologia Não Clínica], o significado clínico desse achado não é conhecido. Se ocorrer uma disfunção menstrual inesperada, os benefícios da continuação do tratamento com AVANDIA devem ser revistos.
topo
Reações adversas
Experiência em ensaios clínicos
Adulto
Em ensaios clínicos, aproximadamente 9.900 pacientes com diabetes tipo 2 foram tratados com AVANDIA.
Ensaios de curta duração do AVANDIA como monoterapia e em combinação com outros agentes hipoglicêmicos
A incidência e os tipos de eventos adversos relatados em ensaios clínicos de curto prazo de AVANDIA em monoterapia são mostrados na Tabela 4.
Quadro 4 Eventos adversos (<5% em qualquer grupo de tratamento) relatados por pacientes em ensaios clínicos de curto prazo * com dupla ocultação * com AVANDIA como monoterapia
| Termo preferido | AVANDIA Monoterapia N = 2.526 % |
Placebo N = 601 % |
Metformina N = 225 % |
Sulfonilureiasâ € N = 626 % |
| Infecção do trato respiratório superior | 9.9 | 8.7 | 8.9 | 7.3 |
| Prejuízo | 7.6 | 4.3 | 7.6 | 6.1 |
| Dor de cabeça | 5.9 | 5.0 | 8.9 | 5.4 |
| Dor nas costas | 4.0 | 3.8 | 4.0 | 5.0 |
| Hiperglicemia | 3.9 | 5.7 | 4.4 | 8.1 |
| Fadiga | 3.6 | 5.0 | 4.0 | 1.9 |
| Sinusite | 3.2 | 4.5 | 5.3 | 3.0 |
| Diarréia | 2.3 | 3.3 | 15.6 | 3.0 |
| Hipoglicemia | 0.6 | 0.2 | 1.3 | 5.9 |
|
* Os ensaios de curto prazo variaram de 8 semanas a 1 ano. †Inclui pacientes que recebem gliburida (N = 514), gliclazida (N = 91) ou glipizida (N = 21). |
No geral, os tipos de reações adversas sem levar em conta a causalidade relatada quando AVANDIA foi usado em combinação com uma sulfonilureia ou metformina foram semelhantes aos da monoterapia com AVANDIA.
Os eventos de anemia e edema tenderam a ser relatados com mais frequência em doses mais altas e geralmente eram de gravidade leve a moderada e geralmente não requeriam a descontinuação do tratamento com AVANDIA.
Em estudos duplo-cegos, foi relatada anemia em 1,9% dos pacientes que receberam AVANDIA em monoterapia, em comparação a 0,7% no placebo, 0,6% nas sulfonilureias e 2,2% na metformina. Os relatos de anemia foram maiores nos pacientes tratados com uma combinação de AVANDIA e metformina (7,1%) e com uma combinação de AVANDIA e uma sulfonilureia mais metformina (6,7%) em comparação à monoterapia com AVANDIA ou em combinação com uma sulfonilureia (2.3%). Os níveis mais baixos de hemoglobina / hematócrito antes do tratamento em pacientes incluídos nos ensaios clínicos combinados com metformina podem ter contribuído para a maior taxa de notificação de anemia nesses estudos [ver REAÇÕES ADVERSAS].
Em ensaios clínicos, foi relatado edema em 4,8% dos pacientes que receberam AVANDIA em monoterapia, em comparação com 1,3% no placebo, 1,0% nas sulfonilureias e 2,2% na metformina. A taxa de notificação de edema foi maior para AVANDIA 8 mg em combinações de sulfonilureia (12,4%) em comparação com outras combinações, com exceção da insulina. Foi relatado edema em 14,7% dos pacientes que receberam AVANDIA nos ensaios combinados de insulina, em comparação com 5,4% somente com insulina. Relatos de novo início ou exacerbação de insuficiência cardíaca congestiva ocorreram a taxas de 1% somente para insulina e 2% (4 mg) e 3% (8 mg) para insulina em combinação com AVANDIA [ver AVISO EM CAIXA e AVISOS E PRECAUÇÕES].
Em estudos de terapia combinada controlada com sulfonilureias, foram relatados sintomas hipoglicêmicos leves a moderados, que parecem estar relacionados à dose. Poucos pacientes foram retirados por hipoglicemia (<1%) e poucos episódios de hipoglicemia foram considerados graves (<1%). A hipoglicemia foi o evento adverso mais frequentemente relatado nos ensaios de combinação de insulina em dose fixa, embora poucos pacientes tenham se retirado por hipoglicemia (4 de 408 para AVANDIA mais insulina e 1 de 203 para insulina sozinho). As taxas de hipoglicemia, confirmadas pela concentração de glicose no sangue capilar <50 mg / dL, foram de 6% somente para insulina e 12% (4 mg) e 14% (8 mg) para insulina em combinação com AVANDIA. [Vejo AVISOS E PRECAUÇÕES.]
Estudo de longo prazo do AVANDIA como monoterapia
Um estudo de 4 a 6 anos (ADOPT) comparou o uso de AVANDIA (n = 1.456), gliburida (n = 1.441) e metformina (n = 1.454) como monoterapia em pacientes recentemente diagnosticados com diabetes tipo 2 que não foram tratados anteriormente com antidiabético medicação. A tabela 5 apresenta reações adversas sem considerar a causalidade; as taxas são expressas por 100 pacientes-ano de exposição (PY) para explicar as diferenças na exposição ao medicamento do estudo nos três grupos de tratamento.
No ADOPT, foram notificadas fraturas em um número maior de mulheres tratadas com AVANDIA (9,3%, 2,7 / 100 anos-paciente) em comparação com gliburida (3,5%, 1,3 / 100 pacientes-ano) ou metformina (5,1%, 1,5 / 100 anos-paciente).
A maioria das fraturas nas mulheres que receberam rosiglitazona foram relatadas na parte superior do braço, mão e pé. [Vejo AVISOS E PRECAUÇÕES.] A incidência observada de fraturas em pacientes do sexo masculino foi semelhante entre os três grupos de tratamento.
Quadro 5 Eventos adversos na terapia (<5 eventos / 100 pacientes-ano [PY]) em qualquer grupo de tratamento relatado em um estudo clínico de 4 a 6 anos do AVANDIA como monoterapia (ADOPT)
| AVANDIA N = 1.456 PY = 4.954 |
Gliburida N = 1.441 PY = 4.244 |
Metformina N = 1.454 PY = 4.906 |
|
| Nasofaringite | 6.3 | 6.9 | 6.6 |
| Dor nas costas | 5.1 | 4.9 | 5.3 |
| Artralgia | 5.0 | 4.8 | 4.2 |
| Hipertensão | 4.4 | 6.0 | 6.1 |
| Infecção do trato respiratório superior | 4.3 | 5.0 | 4.7 |
| Hipoglicemia | 2.9 | 13.0 | 3.4 |
| Diarréia | 2.5 | 3.2 | 6.8 |
Pediatria
O Avandia foi avaliado quanto à segurança em um único estudo controlado e ativo de pacientes pediátricos com diabetes tipo 2, nos quais 99 foram tratados com Avandia e 101 foram tratados com metformina. As reações adversas mais comuns (> 10%), sem levar em consideração a causalidade para Avandia ou metformina, foram cefaleia (17% versus 14%), náusea (4% versus 11%), nasofaringite (3% versus 12%) e diarréia (1% versus 13%). Neste estudo, um caso de cetoacidose diabética foi relatado no grupo da metformina. Além disso, havia três pacientes no grupo da rosiglitazona que tinham FPG de ~ 300 mg / dL, 2+ cetonúria e um hiato aniônico elevado.
Anormalidades laboratoriais
Hematologico
Ocorreram reduções na hemoglobina média e no hematócrito de maneira relacionada à dose em pacientes adultos tratados com Avandia (a média diminui em estudos individuais até 1,0 g / dL de hemoglobina e até 3,3% hematócrito). As alterações ocorreram principalmente durante os primeiros 3 meses após o início da terapia com Avandia ou após um aumento da dose em Avandia. O curso temporal e a magnitude das diminuições foram semelhantes nos pacientes tratados com uma combinação de Avandia e outros agentes hipoglicêmicos ou em monoterapia com Avandia. Os níveis pré-tratamento de hemoglobina e hematócrito foram menores nos pacientes em estudos combinados de metformina e podem ter contribuído para a maior taxa de notificação de anemia. Em um único estudo em pacientes pediátricos, foram relatadas reduções na hemoglobina e no hematócrito (reduções médias de 0,29 g / dL e 0,95%, respectivamente). Pequenas reduções na hemoglobina e no hematócrito também foram relatadas em pacientes pediátricos tratados com Avandia. A contagem de glóbulos brancos também diminuiu ligeiramente em pacientes adultos tratados com Avandia. A diminuição dos parâmetros hematológicos pode estar relacionada ao aumento do volume plasmático observado com o tratamento com Avandia.
Lipídios
Foram observadas alterações nos lipídios séricos após o tratamento com Avandia em adultos [ver Farmacologia Clínica ]. Pequenas alterações nos parâmetros lipídicos séricos foram relatadas em crianças tratadas com Avandia por 24 semanas.
Níveis séricos de transaminase
Em estudos clínicos de pré-aprovação em 4.598 pacientes tratados com Avandia (3.600 pacientes-ano de exposição) e em um período de 4- a Estudo de 6 anos em 1.456 pacientes tratados com Avandia (4.954 pacientes-ano de exposição), não houve evidência de indução hepatotoxicidade.
Em ensaios controlados com pré-aprovação, 0,2% dos pacientes tratados com Avandia tiveram elevações em ALT> 3X o limite superior do normal em comparação com 0,2% no placebo e 0,5% nos comparadores ativos. As elevações da ALT nos pacientes tratados com Avandia foram reversíveis. Hiperbilirrubinemia foi encontrada em 0,3% dos pacientes tratados com Avandia em comparação com 0,9% tratados com placebo e 1% nos pacientes tratados com comparadores ativos. Nos ensaios clínicos de pré-aprovação, não houve casos de reações idiossincráticas a medicamentos levando à insuficiência hepática. [Vejo Avisos e Precauções]
No estudo ADOPT de 4 a 6 anos, os pacientes tratados com Avandia (4.954 pacientes / ano de exposição), gliburida (4.244 pacientes / ano de exposição) ou a metformina (4.906 pacientes-ano de exposição), em monoterapia, teve a mesma taxa de aumento da ALT para> 3X o limite superior do normal (0,3 por 100 pacientes-ano exposição).
Experiência pós-comercialização
Além das reações adversas relatadas nos ensaios clínicos, os eventos descritos abaixo foram identificados durante o uso de Avandia após a aprovação. Como esses eventos são relatados voluntariamente em uma população de tamanho desconhecido, não é possível estimar com segurança sua frequência ou sempre estabelecer uma relação causal com a exposição ao medicamento.
Em pacientes recebendo terapia com tiazolidinediona, eventos adversos graves com ou sem resultado fatal, potencialmente relacionados à expansão do volume (por exemplo, insuficiência cardíaca congestiva, edema pulmonar e derrames pleurais) foram relatados [Vejo Aviso em caixa e Avisos e Precauções].
Existem relatos de pós-comercialização com Avandia de hepatite, elevação das enzimas hepáticas para 3 ou mais vezes o limite superior normal e insuficiência hepática com e sem desfecho fatal, embora a causalidade não tenha sido estabelecido.
Tem sido raramente relatada erupção cutânea, prurido, urticária, angioedema, reação anafilática e síndrome de Stevens-Johnson.
Também foram recebidos relatos de novo início ou agravamento do edema macular diabético com diminuição da acuidade visual [ver Avisos e Precauções].
topo
Interações medicamentosas
Inibidores e indutores do CYP2C8
Um inibidor do CYP2C8 (por exemplo, gemfibrozil) pode aumentar a AUC da rosiglitazona e um indutor do CYP2C8 (por exemplo, rifampina) pode diminuir a AUC da rosiglitazona. Portanto, se um inibidor ou indutor do CYP2C8 for iniciado ou interrompido durante o tratamento com rosiglitazona, podem ser necessárias alterações no tratamento do diabetes com base na resposta clínica. [Vejo FARMACOLOGIA CLÍNICA.]
topo
Uso em populações específicas
Gravidez
Categoria C. da gravidez
Todas as gestações têm um risco de defeitos congênitos, perda ou outro resultado adverso, independentemente da exposição ao medicamento. Esse risco de fundo é aumentado em gestações complicadas por hiperglicemia e pode ser diminuído com um bom controle metabólico. É essencial que pacientes com diabetes ou histórico de diabetes gestacional mantenham um bom controle metabólico antes da concepção e durante a gravidez. O monitoramento cuidadoso do controle da glicose é essencial nesses pacientes. A maioria dos especialistas recomenda que a insulina em monoterapia seja usada durante a gravidez para manter os níveis de glicose no sangue o mais próximo possível do normal.
Dados Humanos: Foi relatado que a rosiglitazona atravessa a placenta humana e é detectável no tecido fetal. O significado clínico destes resultados é desconhecido. Não existem estudos adequados e bem controlados em mulheres grávidas. AVANDIA não deve ser utilizado durante a gravidez.
Estudos em Animais: Não houve efeito no implante ou no embrião com tratamento com rosiglitazona durante o início da gravidez em ratos, mas o tratamento durante a metade da tarde da gestação foi associado à morte fetal e retardo de crescimento em ratos e coelhos. Não foi observada teratogenicidade em doses de até 3 mg / kg em ratos e 100 mg / kg em coelhos (aproximadamente 20 e 75 vezes a AUC humana na dose diária máxima recomendada em humanos, respectivamente). A rosiglitazona causou patologia placentária em ratos (3 mg / kg / dia). O tratamento de ratos durante a gestação durante a lactação reduziu o tamanho da ninhada, a viabilidade neonatal e o crescimento pós-natal, com retardo de crescimento reversível após a puberdade. Para efeitos na placenta, embrião / feto e filhotes, a dose sem efeito foi de 0,2 mg / kg / dia em ratos e 15 mg / kg / dia em coelhos. Estes níveis sem efeito são aproximadamente 4 vezes a AUC humana na dose diária diária máxima recomendada. A rosiglitazona reduziu o número de implantes uterinos e gerou vida quando ratos fêmeas jovens foram tratadas aos 40 mg / kg / dia a partir dos 27 dias de idade até a maturidade sexual (aproximadamente 68 vezes a AUC humana na máxima diária recomendada dose). O nível sem efeito foi de 2 mg / kg / dia (aproximadamente 4 vezes a AUC humana na dose diária máxima recomendada). Não houve efeito na sobrevivência ou crescimento pré ou pós-natal.
Trabalho e entrega
O efeito da rosiglitazona no trabalho de parto e parto em humanos não é conhecido.
Mães que amamentam
Material relacionado a drogas foi detectado no leite de ratos lactantes. Não se sabe se AVANDIA é excretado no leite humano. Como muitos medicamentos são excretados no leite humano, AVANDIA não deve ser administrado a uma mulher que amamenta.
Uso pediátrico
Após a administração do placebo, incluindo aconselhamento dietético, crianças com diabetes mellitus tipo 2, com idades entre 10 e 17 anos e com um índice de massa corporal (IMC) médio de 33 kg / m, foram randomizados para tratamento com 2 mg duas vezes ao dia de AVANDIA (n = 99) ou 500 mg duas vezes ao dia de metformina (n = 101) em um ensaio clínico de 24 semanas, duplo-cego tentativas. Como esperado, a FPG diminuiu nos pacientes que não tomavam medicamentos para diabetes (n = 104) e aumentou nos pacientes retirados de medicamentos anteriores (geralmente metformina) (n = 90) durante o período de amaciamento. Após pelo menos 8 semanas de tratamento, 49% dos pacientes tratados com AVANDIA e 55% dos pacientes tratados com metformina tiveram sua dose dobrada se FPG> 126 mg / dL. Para a população geral com intenção de tratar, na semana 24, a alteração média da linha de base na HbA1c foi de -0,14% com AVANDIA e -0,49% com metformina. Havia um número insuficiente de pacientes neste estudo para estabelecer estatisticamente se esses
os efeitos médios observados do tratamento foram semelhantes ou diferentes. Os efeitos do tratamento diferiram nos pacientes que não receberam terapia com medicamentos antidiabéticos e nos pacientes tratados anteriormente com terapia antidiabética (Tabela 6).
Quadro 6 Semana 24 Mudança de FPG e HbA1c do início da última observação realizada em crianças com HbA1c inicial> 6,5%
| Pacientes ingênuos | Pacientes tratados anteriormente | |||
|
Metformina N = 40 |
Rosiglitazona N = 45 |
Metformina N = 43 |
Rosiglitazona N = 32 |
|
| FPG (mg / dL) | ||||
| Linha de base (média) | 170 | 165 | 221 | 205 |
| Alterar da linha de base (média) | -21 | -11 | -33 | -5 |
| Diferença de tratamento ajustada * (rosiglitazona-metformina) â (IC 95%) | 8 (-15, 30) |
21 (-9, 51) |
||
| % de pacientes com <30 mg / dL diminuem da linha de base | 43% | 27% | 44% | 28% |
| HbA1c (%) | ||||
| Linha de base (média) | 8.3 | 8.2 | 8.8 | 8.5 |
| Alterar da linha de base (média) | -0.7 | -0.5 | -0.4 | 0.1 |
| Diferença de tratamento ajustada * (rosiglitazona-metformina) â (IC 95%) | 0.2 (-0.6, 0.9) |
0.5 (-0.2, 1.3) |
||
| % de pacientes com <0,7% de redução em relação à linha de base | 63% | 52% | 54% | 31% |
|
* Mudar das médias da linha de base são mínimos quadrados, significa ajustar para a HbA1c da linha de base, gênero e região. †Valores positivos para a diferença favorecem a metformina. |
As diferenças de tratamento dependiam do IMC ou do peso basal, de modo que os efeitos de AVANDIA e metformina parecessem mais comparáveis entre pacientes mais pesados. O ganho médio de peso foi de 2,8 kg com rosiglitazona e 0,2 kg com metformina [ver AVISOS E PRECAUÇÕES]. Cinquenta e quatro por cento dos pacientes tratados com rosiglitazona e 32% dos pacientes tratados com metformina obtiveram <2 kg e 33% dos pacientes tratados com rosiglitazona e 7% dos pacientes tratados com metformina ganharam> 5 kg em estude.
Os eventos adversos observados neste estudo estão descritos em Reações adversas).
Figura 3. HbA1c média ao longo do tempo em um estudo de 24 semanas de AVANDIA e metformina em pacientes pediátricos - subgrupo Drug-Naïve
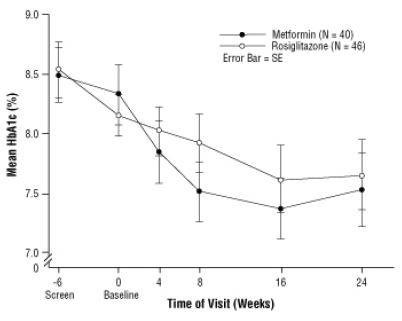
Uso Geriátrico
Os resultados da análise farmacocinética da população mostraram que a idade não afeta significativamente a farmacocinética da rosiglitazona [ver FARMACOLOGIA CLÍNICA]. Portanto, nenhum ajuste posológico é necessário para os idosos. Em ensaios clínicos controlados, não foram observadas diferenças gerais em segurança e eficácia entre pacientes mais velhos (> 65 anos) e mais jovens (<65 anos).
topo
Sobredosagem
Dados limitados estão disponíveis com relação à superdosagem em humanos. Em estudos clínicos em voluntários, AVANDIA foi administrado em doses orais únicas de até 20 mg e foi bem tolerado. No caso de uma overdose, o tratamento de suporte apropriado deve ser iniciado conforme o estado clínico do paciente.
topo
Descrição
O AVANDIA (maleato de rosiglitazona) é um agente antidiabético oral que atua principalmente pelo aumento da sensibilidade à insulina. AVANDIA melhora o controle glicêmico enquanto reduz os níveis circulantes de insulina.
O maleato de rosiglitazona não está quimicamente ou funcionalmente relacionado com as sulfonilureias, as biguanidas ou os inibidores da alfa-glucosidase.
Quimicamente, o maleato de rosiglitazona é (±) -5 - [[4- [2- (metil-2-piridinilamino) etoxi] fenil] metil] -2,4-tiazolidinediona, (Z) -2-butenodioato (1: 1) com um peso molecular de 473,52 (base livre de 357,44). A molécula tem um único centro quiral e está presente como um racemato. Devido à rápida interconversão, os enantiômeros são funcionalmente indistinguíveis. A fórmula estrutural do maleato de rosiglitazona é:

A fórmula molecular é C18H19N3O3S-C4H4O4. O maleato de rosiglitazona é um sólido branco a esbranquiçado com um intervalo de pontos de fusão de 122 a 123 ° C. Os valores de pKa do maleato de rosiglitazona são 6,8 e 6,1. É facilmente solúvel em etanol e um solução aquosa tamponada com pH de 2,3; a solubilidade diminui com o aumento do pH na fisiologia alcance.
Cada comprimido TILTAB revestido por película pentagonal contém maleato de rosiglitazona equivalente a rosiglitazona, 2 mg, 4 mg ou 8 mg, para administração oral. Os ingredientes inativos são: Hipromelose 2910, lactose monohidratada, estearato de magnésio, celulose microcristalina, polietileno glicol 3000, glicolato de amido sódico, dióxido de titânio, triacetina e 1 ou mais dos seguintes materiais: Óxidos de ferro vermelho e amarelo sintéticos e talco.
topo
Farmacologia Clínica
Mecanismo de ação
A rosiglitazona, um membro da classe dos antidiabéticos tiazolidinediona, melhora o controle glicêmico, melhorando a sensibilidade à insulina. A rosiglitazona é um agonista altamente seletivo e potente para o receptor gama ativado por proliferador de peroxissomo (PPARy). Em humanos, os receptores PPAR são encontrados nos principais tecidos-alvo da ação da insulina, como tecido adiposo, músculo esquelético e fígado. A activação dos receptores nucleares de PPARy regula a transcrição de genes que respondem à insulina envolvidos no controlo da produção, transporte e utilização de glucose. Além disso, os genes responsivos ao PPARy também participam na regulação do metabolismo dos ácidos graxos.
A resistência à insulina é uma característica comum que caracteriza a patogênese do diabetes tipo 2. A atividade antidiabética da rosiglitazona foi demonstrada em modelos animais de diabetes tipo 2 em hiperglicemia e / ou tolerância diminuída à glicose é uma conseqüência da resistência à insulina no alvo tecidos. A rosiglitazona reduz as concentrações de glicose no sangue e reduz a hiperinsulinemia no camundongo ob / ob obeso, camundongo diabético db / db e rato Zucker gordo fa / fa.
Em modelos animais, a atividade antidiabética da rosiglitazona demonstrou ser mediada pelo aumento da sensibilidade à ação da insulina no fígado, músculo e tecidos adiposos. Estudos farmacológicos em modelos animais indicam que a rosiglitazona inibe a gliconeogênese hepática. A expressão do transportador de glicose regulado por insulina GLUT-4 foi aumentada no tecido adiposo. A rosiglitazona não induziu hipoglicemia em modelos animais de diabetes tipo 2 e / ou tolerância à glicose diminuída.
Farmacodinâmica
Pacientes com anormalidades lipídicas não foram excluídos dos ensaios clínicos de AVANDIA.
Em todos os ensaios controlados de 26 semanas, no intervalo de doses recomendado, o AVANDIA como monoterapia foi associado a aumentos no colesterol total, LDL e HDL e a uma diminuição nos ácidos graxos livres. Essas alterações foram estatisticamente significativamente diferentes dos controles placebo ou gliburida (Tabela 7).
Os aumentos no LDL ocorreram principalmente durante os primeiros 1 a 2 meses de terapia com AVANDIA e os níveis de LDL permaneceram elevados acima da linha de base ao longo dos ensaios. Em contraste, o HDL continuou a aumentar ao longo do tempo. Como resultado, a relação LDL / HDL atingiu o pico após 2 meses de terapia e depois pareceu diminuir ao longo do tempo. Devido à natureza temporal das alterações lipídicas, o estudo controlado por gliburide de 52 semanas é mais pertinente para avaliar os efeitos a longo prazo nos lipídios. No início, na semana 26 e na semana 52, as proporções médias de LDL / HDL foram de 3,1, 3,2 e 3,0, respectivamente, para AVANDIA 4 mg duas vezes ao dia. Os valores correspondentes para gliburida foram 3,2, 3,1 e 2,9. As diferenças na mudança da linha de base entre AVANDIA e gliburida na semana 52 foram estatisticamente significativas.
O padrão das alterações de LDL e HDL após a terapêutica com AVANDIA em associação com outros agentes hipoglicémicos foi geralmente semelhante ao observado com AVANDIA em monoterapia.
As alterações nos triglicerídeos durante o tratamento com AVANDIA foram variáveis e geralmente não foram estatisticamente diferentes dos controles placebo ou gliburida.
Quadro 7 Resumo das alterações lipídicas médias em estudos de monoterapia com 26 semanas controlados com placebo e 52 semanas com monoterapia com gliburida
| Semana 26 de estudos controlados por placebo | Semana 26 e 52 do Estudo Controlado por Gliburida | ||||||
| Placebo | AVANDIA | Titulação de Gliburida | AVANDIA 8 mg | ||||
| 4 mg por dia * | 8 mg por dia * | Semana 26 | Semana 52 | Semana 26 | Semana 52 | ||
| Ácidos graxos livres | |||||||
| N | 207 | 428 | 436 | 181 | 168 | 166 | 145 |
| Linha de base (média)% | 18.1 | 17.5 | 17.9 | 26.4 | 26.4 | 26.9 | 26.6 |
| Alterar da linha de base (média) | +0.2% | -7.8% | -14.7% | -2.4% | -4.7% | -20.8% | -21.5% |
| LDL | |||||||
| N | 190 | 400 | 374 | 175 | 160 | 161 | 133 |
| Linha de base (média)% | 123.7 | 126.8 | 125.3 | 142.7 | 141.9 | 142.1 | 142.1 |
| Alterar da linha de base (média) | +4.8% | +14.1% | +18.6% | -0.9% | -0.5% | +11.9% | +12.1% |
| HDL | |||||||
| N | 208 | 429 | 436 | 184 | 170 | 170 | 145 |
| Linha de base (média)% | 44.1 | 44.4 | 43.0 | 47.2 | 47.7 | 48.4 | 48.3 |
| Alterar da linha de base (média) | +8.0% | +11.4% | +14.2% | +4.3% | +8.7% | +14.0% | +18.5% |
| * Os grupos de dosagem uma vez ao dia e duas vezes ao dia foram combinados. |
Farmacocinética
A concentração plasmática máxima (Cmax) e a área sob a curva (AUC) da rosiglitazona aumentam proporcionalmente à dose no intervalo de doses terapêuticas (Tabela 8). A meia-vida de eliminação é de 3 a 4 horas e é independente da dose.
Quadro 8 Parâmetros farmacocinéticos médios (DP) para rosiglitazona após doses orais únicas (N = 32)
| Parâmetro | 1 mg em jejum | 2 mg em jejum | 8 mg em jejum | 8 mg Fed |
| AUC0-inf [ng-h / mL] |
358 (112) |
733 (184) |
2,971 (730) |
2,890 (795) |
| Cmax [ng / mL] |
76 (13) |
156 (42) |
598 (117) |
432 (92) |
| Meia vida [h] |
3.16 (0.72) |
3.15 (0.39) |
3.37 (0.63) |
3.59 (0.70) |
| CL / F * [L / h] |
3.03 (0.87) |
2.89 (0.71) |
2.85 (0.69) |
2.97 (0.81) |
| * CL / F = Liberação oral. |
Absorção
A biodisponibilidade absoluta da rosiglitazona é de 99%. As concentrações plasmáticas máximas são observadas cerca de 1 hora após a administração. A administração de rosiglitazona com alimentos não resultou em alterações na exposição geral (AUC), mas houve uma diminuição de aproximadamente 28% na Cmax e um atraso na Tmax (1,75 horas). É provável que essas mudanças não sejam clinicamente significativas; portanto, AVANDIA pode ser administrado com ou sem alimentos.
Distribuição
O volume médio de distribuição oral (CV%) (Vss / F) da rosiglitazona é de aproximadamente 17,6 (30%) litros, com base em uma análise farmacocinética da população. A rosiglitazona está ligada aproximadamente a 99,8% às proteínas plasmáticas, principalmente a albumina.
Metabolismo
A rosiglitazona é extensivamente metabolizada sem nenhum medicamento inalterado excretado na urina. As principais vias de metabolismo foram N-desmetilação e hidroxilação, seguidas pela conjugação com sulfato e ácido glucurônico. Todos os metabolitos circulantes são consideravelmente menos potentes que os progenitores e, portanto, não se espera que contribuam para a atividade sensibilizante à insulina da rosiglitazona.
Dados in vitro demonstram que a rosiglitazona é predominantemente metabolizada pela isoenzima 2C8 do citocromo P450 (CYP), com o CYP2C9 contribuindo como uma via menor.
Excreção
Após a administração oral ou intravenosa de maleato de [14C] rosiglitazona, aproximadamente 64% e 23% da dose foram eliminados na urina e nas fezes, respectivamente. A meia-vida plasmática do material relacionado ao [14C] variou de 103 a 158 horas.
Farmacocinética da População em Pacientes com Diabetes Tipo 2
Análises farmacocinéticas da população de três grandes ensaios clínicos, incluindo 642 homens e 405 mulheres com diabetes tipo 2 (35 anos 80 anos) mostrou que a farmacocinética da rosiglitazona não é influenciada pela idade, raça, tabagismo ou álcool consumo. Tanto a depuração oral (CL / F) quanto o volume de distribuição oral no estado estacionário (Vss / F) aumentaram com o aumento do peso corporal. Sobre a faixa de peso observada nessas análises (50 a 150 kg), a faixa dos valores previstos de CL / F e Vss / F variou em <1,7 vezes e <2,3 vezes, respectivamente.
Além disso, a rosiglitazona CL / F mostrou ser influenciada por peso e sexo, sendo menor (cerca de 15%) em pacientes do sexo feminino.
Populações Especiais
Geriátrico
Resultados da análise farmacocinética da população (n = 716 <65 anos; n = 331 ± 65 anos) mostrou que a idade não afeta significativamente a farmacocinética da rosiglitazona.
Gênero
Os resultados da análise farmacocinética da população mostraram que a depuração oral média da rosiglitazona em pacientes do sexo feminino (n = 405) foi aproximadamente 6% menor em comparação com pacientes do mesmo peso corporal (n = 642).
Como monoterapia e em combinação com metformina, AVANDIA melhorou o controle glicêmico em homens e mulheres. Em estudos de combinação de metformina, a eficácia foi demonstrada sem diferenças de gênero na resposta glicêmica.
Nos estudos em monoterapia, uma maior resposta terapêutica foi observada no sexo feminino; no entanto, em pacientes mais obesos, as diferenças entre os sexos foram menos evidentes. Para um dado índice de massa corporal (IMC), as mulheres tendem a ter uma massa gorda maior que os homens. Uma vez que o alvo molecular PPARy é expresso nos tecidos adiposos, esta característica diferenciadora pode ser responsável, pelo menos em parte, pela maior resposta a AVANDIA em mulheres. Como a terapia deve ser individualizada, nenhum ajuste de dose é necessário com base apenas no sexo.
Compromisso hepático
A depuração oral ilimitada da rosiglitazona foi significativamente menor em pacientes com doença hepática moderada a grave (Classe B / C de Child-Pugh) em comparação com indivíduos saudáveis. Como resultado, a Cmax não ligada e a AUC0-inf aumentaram 2 e 3 vezes, respectivamente. A meia-vida de eliminação da rosiglitazona foi cerca de 2 horas a mais em pacientes com doença hepática, em comparação com indivíduos saudáveis.
A terapêutica com AVANDIA não deve ser iniciada se o doente apresentar evidência clínica de doença hepática ou aumento dos níveis séricos de transaminase (ALT> 2,5 vezes o limite superior do normal) no início [Vejo AVISOS E PRECAUÇÕES].
Pediatria
Os parâmetros farmacocinéticos da rosiglitazona em pacientes pediátricos foram estabelecidos usando uma análise farmacocinética populacional com dados esparsos de 96 pacientes pediátricos em um único ensaio clínico pediátrico, incluindo 33 homens e 63 mulheres com idades variando de 10 a 17 anos (pesos variando de 35 a 178,3 kg). A população média CL / F e V / F da rosiglitazona foi de 3,15 L / h e 13,5 L, respectivamente. Essas estimativas de CL / F e V / F foram consistentes com as estimativas típicas de parâmetros de uma análise anterior da população adulta.
Insuficiência renal
Não existem diferenças clinicamente relevantes na farmacocinética da rosiglitazona em doentes com insuficiência renal grave ou em pacientes dependentes de hemodiálise em comparação com indivíduos com insuficiência renal normal função. Portanto, nenhum ajuste posológico é necessário em pacientes que recebem AVANDIA. Uma vez que a metformina é contra-indicada em pacientes com insuficiência renal, a co-administração de metformina com AVANDIA é contra-indicada nesses pacientes.
Raça
Os resultados de uma análise farmacocinética populacional, incluindo indivíduos de origem caucasiana, negra e outras etnias, indicam que a raça não tem influência na farmacocinética da rosiglitazona.
Interações medicamentosas
Medicamentos que inibem, induzem ou são metabolizados pelo citocromo P450
Estudos de metabolismo de drogas in vitro sugerem que a rosiglitazona não inibe nenhuma das principais enzimas P450 em concentrações clinicamente relevantes. Dados in vitro demonstram que a rosiglitazona é predominantemente metabolizada pelo CYP2C8 e, em menor grau, 2C9. AVANDIA (4 mg duas vezes por dia) demonstrou não ter efeito clinicamente relevante na farmacocinética de nifedipina e contraceptivos orais (etinilestradiol e noretindrona), que são predominantemente metabolizados pelo CYP3A4.
Gemfibrozil
Administração concomitante de gemfibrozil (600 mg duas vezes ao dia), inibidor do CYP2C8 e rosiglitazona (4 mg uma vez diariamente) durante 7 dias, aumentou a AUC da rosiglitazona em 127%, em comparação com a administração de rosiglitazona (4 mg uma vez ao dia) sozinho. Dado o potencial de eventos adversos relacionados à dose com rosiglitazona, pode ser necessária uma diminuição na dose de rosiglitazona quando o gemfibrozil é introduzido [ver INTERAÇÕES MEDICAMENTOSAS].
Rifampin
É relatado que a administração de rifampicina (600 mg uma vez por dia), um indutor do CYP2C8, por 6 dias, diminui a AUC da rosiglitazona em 66%, em comparação com a administração de rosiglitazona (8 mg) isoladamente [ver INTERAÇÕES MEDICAMENTOSAS].4
Gliburida
AVANDIA (2 mg duas vezes ao dia) administrado concomitantemente com gliburida (3,75 a 10 mg / dia) por 7 dias não alterou as concentrações médias de glicose no plasma no estado estacionário de 24 horas em pacientes diabéticos estabilizadas com gliburida terapia. Repetir doses de AVANDIA (8 mg uma vez ao dia) por 8 dias em indivíduos adultos caucasianos saudáveis causou uma diminuição na AUC e na Cmax da gliburida de aproximadamente 30%. Em indivíduos japoneses, a AUC e a Cmax da gliburida aumentaram ligeiramente após a co-administração de AVANDIA.
Glimepirida
Doses orais únicas de glimepirida em 14 indivíduos adultos saudáveis não tiveram efeito clinicamente significativo na farmacocinética em estado estacionário de AVANDIA. Nenhuma redução clinicamente significativa na AUC e C da glimepiridamax foram observados após doses repetidas de AVANDIA (8 mg uma vez por dia) durante 8 dias em indivíduos adultos saudáveis.
Metformina
A administração concomitante de AVANDIA (2 mg duas vezes ao dia) e metformina (500 mg duas vezes ao dia) em voluntários por 4 dias não tiveram efeito na farmacocinética no estado estacionário da metformina ou rosiglitazona.
Acarbose
A administração concomitante de acarbose (100 mg três vezes ao dia) durante 7 dias em voluntários saudáveis não teve efeito clinicamente relevante na farmacocinética de uma dose oral única de AVANDIA.
Digoxina
A administração repetida de AVANDIA (8 mg uma vez ao dia) por 14 dias não alterou a farmacocinética no estado estacionário da digoxina (0,375 mg uma vez ao dia) em voluntários saudáveis.
Varfarina
A administração repetida de AVANDIA não teve efeito clinicamente relevante na farmacocinética em estado estacionário dos enantiómeros de varfarina.
Etanol
Uma administração única de uma quantidade moderada de álcool não aumentou o risco de hipoglicemia aguda em pacientes com diabetes mellitus tipo 2 tratados com AVANDIA.
Ranitidina
O pré-tratamento com ranitidina (150 mg duas vezes ao dia por 4 dias) não alterou a farmacocinética de doses orais ou intravenosas únicas de rosiglitazona em voluntários saudáveis.
Estes resultados sugerem que a absorção da rosiglitazona oral não é alterada em condições acompanhadas por aumentos no pH gastrointestinal.
topo
Toxicologia Não Clínica
Carcinogênese, mutagênese, comprometimento da fertilidade
Carcinogênese:
Um estudo de carcinogenicidade de 2 anos foi realizado em camundongos CD-1 Charles River nas doses de 0,4, 1,5 e 6 mg / kg / dia em a dieta (dose mais alta equivalente a aproximadamente 12 vezes a AUC humana na dose diária máxima recomendada dose). Os ratos Sprague-Dawley foram dosados por 2 anos por gavagem oral nas doses de 0,05, 0,3 e 2 mg / kg / dia (dose mais alta equivalente a aproximadamente 10 e 20 vezes a AUC humana na dose diária humana máxima recomendada para ratos machos e fêmeas, respectivamente).
A rosiglitazona não era cancerígena no camundongo. Houve um aumento na incidência de hiperplasia adiposa no camundongo em doses de 1,5 mg / kg / dia (aproximadamente 2 vezes a AUC humana na dose diária humana máxima recomendada). Em ratos, houve um aumento significativo na incidência de tumores benignos do tecido adiposo (lipomas) em doses de 0,3 mg / kg / dia (aproximadamente 2 vezes a AUC humana na dose diária humana máxima recomendada). Essas alterações proliferativas em ambas as espécies são consideradas devido à superestimulação farmacológica persistente do tecido adiposo.
Mutagênese:
A rosiglitazona não foi mutagênica ou clastogênica nos ensaios bacterianos in vitro para mutação genética, a in vitro teste de aberração cromossômica em linfócitos humanos, teste de micronúcleo de camundongo in vivo e UDS de rato in vivo / in vitro ensaio. Houve um pequeno aumento (cerca de 2 vezes) na mutação no ensaio de linfoma de camundongo in vitro na presença de ativação metabólica.
Comprometimento da fertilidade:
A rosiglitazona não teve efeitos no acasalamento ou na fertilidade de ratos machos administrados até 40 mg / kg / dia (aproximadamente 116 vezes a AUC humana na dose diária máxima humana recomendada). A rosiglitazona alterou a ciclicidade do estro (2 mg / kg / dia) e a fertilidade reduzida (40 mg / kg / dia) de ratos fêmeas em associação com menor níveis plasmáticos de progesterona e estradiol (aproximadamente 20 e 200 vezes a AUC humana na dose diária diária máxima recomendada, respectivamente). Não foram observados tais efeitos em 0,2 mg / kg / dia (aproximadamente 3 vezes a AUC humana na dose diária máxima recomendada em humanos). Em ratos juvenis dosados a partir dos 27 dias de idade até a maturidade sexual (até 40 mg / kg / dia), não houve efeito no desempenho reprodutivo masculino, ou sobre ciclicidade do estro, desempenho de acasalamento ou incidência de gravidez em fêmeas (aproximadamente 68 vezes a AUC humana na dose diária máxima recomendada em humanos dose). Nos macacos, a rosiglitazona (0,6 e 4,6 mg / kg / dia; aproximadamente 3 e 15 vezes a AUC humana na dose diária máxima recomendada, respectivamente) diminuíram o aumento da fase folicular no estradiol sérico, com conseqüente redução do aumento do hormônio luteinizante, níveis mais baixos de progesterona na fase lútea e amenorréia. O mecanismo para esses efeitos parece ser a inibição direta da esteroidogênese ovariana.
Toxicologia Animal
Os pesos cardíacos aumentaram em camundongos (3 mg / kg / dia), ratos (5 mg / kg / dia) e cães (2 mg / kg / dia) com rosiglitazona tratamentos (aproximadamente 5, 22 e 2 vezes a AUC humana na dose diária humana máxima recomendada, respectivamente). Os efeitos em ratos juvenis foram consistentes com os observados em adultos. A medida morfométrica indicou que havia hipertrofia nos tecidos ventriculares cardíacos, o que pode ser devido ao aumento do trabalho cardíaco como resultado da expansão do volume plasmático.
topo
Estudos clínicos
Monoterapia
Em estudos clínicos, o tratamento com AVANDIA resultou em uma melhora no controle glicêmico, medido por FPG e HbA1c, com uma redução simultânea de insulina e peptídeo C. Glicose pós-prandial e insulina também foram reduzidas. Isso é consistente com o mecanismo de ação do AVANDIA como sensibilizador à insulina.
A dose diária máxima recomendada é de 8 mg. Estudos de variação de dose sugeriram que nenhum benefício adicional foi obtido com uma dose diária total de 12 mg.
Estudos clínicos de curto prazo: Um total de 2.315 pacientes com diabetes tipo 2, previamente tratados apenas com dieta ou medicamentos antidiabéticos, foram tratados com AVANDIA em monoterapia em 6 pacientes estudos, que incluíram dois estudos controlados por placebo de 26 semanas, um estudo controlado de gliburide de 52 semanas e 3 estudos de variação de dose controlados por placebo de 8 a 12 semanas de duração. Os medicamentos antidiabéticos anteriores foram retirados e os pacientes entraram em um período inicial de placebo de 2 a 4 semanas antes da randomização.
Dois estudos de 26 semanas, duplo-cegos, controlados por placebo, em pacientes com diabetes tipo 2 (n = 1.401) com glicemia inadequada controle (FPG basal médio aproximadamente 228 mg / dL [101 a 425 mg / dL] e HbA1c basal médio 8,9% [5,2% a 16,2%]), foram conduzido. O tratamento com AVANDIA produziu melhorias estatisticamente significativas no FPG e HbA1c em comparação ao basal e em relação ao placebo. Os dados de um desses estudos estão resumidos na Tabela 9.
Tabela 9: Parâmetros glicêmicos em um ensaio controlado por placebo de 26 semanas
| Placebo N = 173 |
AVANDIA | AVANDIA | |||
| 4 mg uma vez ao dia N = 180 |
2 mg duas vezes ao dia N = 186 |
8 mg uma vez ao dia N = 181 |
4 mg duas vezes ao dia N = 187 |
||
| FPG (mg / dL) | |||||
| Linha de base (média) | 225 | 229 | 225 | 228 | 228 |
| Alterar da linha de base (média) | 8 | -25 | -35 | -42 | -55 |
| Diferença do placebo (média ajustada) | - | -31* | -43* | -49* | -62* |
| % de pacientes com <30 mg / dL diminuem da linha de base | 19% | 45% | 54% | 58% | 70% |
| HbA1c (%) | |||||
| Linha de base (média) | 8.9 | 8.9 | 8.9 | 8.9 | 9.0 |
| Alterar da linha de base (média) | 0.8 | 0.0 | -0.1 | -0.3 | -0.7 |
| Diferença do placebo (média ajustada) | - | -0.8* | -0.9* | -1.1* | -1.5* |
| % de pacientes com <0,7% de redução em relação à linha de base | 9% | 28% | 29% | 39% | 54% |
| * p <0,0001 comparado ao placebo. |
Quando administrado na mesma dose diária total, AVANDIA foi geralmente mais eficaz na redução de FPG e HbA1c quando administrado em doses divididas duas vezes ao dia em comparação com doses uma vez ao dia. No entanto, para HbA1c, a diferença entre as doses de 4 mg uma vez ao dia e 2 mg duas vezes ao dia não foi estatisticamente significativa.
Estudos clínicos de longo prazo
A manutenção do efeito a longo prazo foi avaliada em um estudo de 52 semanas, duplo-cego e controlado por gliburida em pacientes com diabetes tipo 2. Os pacientes foram randomizados para o tratamento com AVANDIA 2 mg duas vezes ao dia (N = 195) ou AVANDIA 4 mg duas vezes ao dia (N = 189) ou gliburida (N = 202) por 52 semanas. Os pacientes que receberam gliburida receberam uma dose inicial de 2,5 mg / dia ou 5,0 mg / dia. A dosagem foi então titulada em incrementos de 2,5 mg / dia nas próximas 12 semanas, até uma dose máxima de 15,0 mg / dia, a fim de otimizar o controle glicêmico. Depois disso, a dose de gliburida foi mantida constante.
A dose média titulada de gliburida foi de 7,5 mg. Todos os tratamentos resultaram em uma melhoria estatisticamente significativa no controle glicêmico desde o início (Figura 4 e Figura 5). No final da semana 52, a redução da linha de base na FPG e HbA1c foi de -40,8 mg / dL e -0,53% com AVANDIA 4 mg duas vezes ao dia; -25,4 mg / dL e -0,27% com AVANDIA 2 mg duas vezes ao dia; e -30,0 mg / dL e -0,72% com gliburida. Para HbA1c, a diferença entre AVANDIA 4 mg duas vezes ao dia e gliburida não foi estatisticamente significativa na semana 52. A queda inicial no FPG com gliburida foi maior que no AVANDIA; no entanto, esse efeito foi menos durável ao longo do tempo.
A melhoria no controle glicêmico observada com AVANDIA 4 mg duas vezes ao dia na semana 26 foi mantida até a semana 52 do estudo.
Figura 4. FPG médio ao longo do tempo em um estudo controlado por gliburida de 52 semanas

Figura 5. Média de HbA1c ao longo do tempo em um estudo controlado por glicemia de 52 semanas
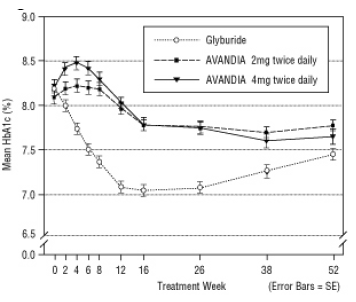
Foi relatada hipoglicemia em 12,1% dos pacientes tratados com gliburida versus 0,5% (2 mg duas vezes ao dia) e 1,6% (4 mg duas vezes ao dia) dos pacientes tratados com AVANDIA. As melhorias no controle glicêmico foram associadas a um ganho de peso médio de 1,75 kg e 2,95 kg para doentes tratados com 2 mg e 4 mg duas vezes por dia de AVANDIA, respectivamente, contra 1,9 kg em doentes tratados com gliburida pacientes. Nos pacientes tratados com AVANDIA, produtos com peptídeo C, insulina, pró-insulina e pró-insulina foram significativamente reduzido de maneira ordenada por dose, em comparação com um aumento no tratamento tratado com gliburida pacientes.
Um estudo de progressão de resultados de diabetes (ADOPT) foi um estudo multicêntrico, duplo-cego e controlado (N = 4.351), realizado durante 4 a 6 anos para comparar a segurança e eficácia monoterapia com AVANDIA, metformina e gliburida em pacientes recentemente diagnosticados com diabetes mellitus tipo 2 (<3 anos) inadequadamente controlados com dieta e exercício. A idade média dos pacientes neste estudo foi de 57 anos e a maioria dos pacientes (83%) não tinha histórico conhecido de doença cardiovascular. A média basal de FPG e HbA1c foi de 152 mg / dL e 7,4%, respectivamente. Os pacientes foram randomizados para receber AVANDIA 4 mg uma vez ao dia, gliburida 2,5 mg uma vez ao dia ou metformina 500 mg uma vez ao dia, e as doses foram titulado para controle glicêmico ideal até um máximo de 4 mg duas vezes ao dia para AVANDIA, 7,5 mg duas vezes ao dia para gliburida e 1.000 mg duas vezes ao dia para AVANDIA metformina. O desfecho primário de eficácia foi o tempo de FPG consecutivo> 180 mg / dL após pelo menos 6 semanas de tratamento no máximo dose tolerada de medicamento do estudo ou tempo para controle glicêmico inadequado, conforme determinado por um julgamento independente comitê.
A incidência cumulativa do resultado primário de eficácia em 5 anos foi de 15% com AVANDIA, 21% com metformina e 34% com gliburida (taxa de risco de 0,68 [IC 95% 0,55, 0,85] versus metformina, HR 0,37 [IC 95% 0,30, 0,45] versus gliburida).
Os dados cardiovasculares e de eventos adversos (incluindo efeitos no peso corporal e fratura óssea) de ADOPT for AVANDIA, metformina e gliburida são descritos em AVISOS E PRECAUÇÕES e REAÇÕES ADVERSAS, respectivamente. Como com todos os medicamentos, os resultados da eficácia devem ser considerados juntamente com as informações de segurança para avaliar o potencial benefício e risco para um paciente individual.
Combinação com Metformina ou Sulfonilureia
A adição de AVANDIA à metformina ou sulfonilureia resultou em reduções significativas na hiperglicemia em comparação com qualquer um desses agentes isoladamente. Estes resultados são consistentes com um efeito aditivo no controle glicêmico quando AVANDIA é usado como terapia combinada.
Combinação com Metformina
Um total de 670 pacientes com diabetes tipo 2 participou de duas sessões de 26 semanas, randomizadas, duplo-cegas, estudos controlados com placebo / ativo, projetados para avaliar a eficácia de AVANDIA em combinação com metformina. AVANDIA, administrado em regimes posológicos uma vez ao dia ou duas vezes ao dia, foi adicionado à terapia de pacientes que foram inadequadamente controlados com uma dose máxima (2,5 gramas / dia) de metformina.
Em um estudo, pacientes controlados inadequadamente com 2,5 gramas / dia de metformina (média basal de GPJ 216 mg / dL e média basal HbA1c 8,8%) foram randomizados para receber 4 mg de AVANDIA uma vez ao dia, 8 mg de AVANDIA uma vez ao dia ou placebo, além de metformina. Foi observada uma melhora estatisticamente significativa na FPG e HbA1c nos pacientes tratados com as combinações de metformina e 4 mg de AVANDIA uma vez ao dia e 8 mg de AVANDIA uma vez ao dia, versus os pacientes que continuaram apenas com metformina (Tabela 10)
Quadro 10 Parâmetros glicêmicos em um estudo de combinação de 26 semanas com AVANDIA Plus Metformina
| Metformina N = 113 |
AVANDIA 4 mg uma vez ao dia + metformina N = 116 |
AVANDIA 8 mg uma vez ao dia + metformina N = 110 |
|
| FPG (mg / dL) | |||
| Linha de base (média) | 214 | 215 | 220 |
| Alterar da linha de base (média) | 6 | -33 | -48 |
| Diferença da metformina isolada (média ajustada) | - | -40* | -53* |
| % de pacientes com <30 mg / dL diminuem da linha de base | 20% | 45% | 61% |
| HbA1c (%) | |||
| Linha de base (média) | 8.6 | 8.9 | 8.9 |
| Alterar da linha de base (média) | 0.5 | -0.6 | -0.8 |
| Diferença da metformina isolada (média ajustada) | - | -1.0* | -1.2* |
| % de pacientes com <0,7% de redução em relação à linha de base | 11% | 45% | 52% |
| * p <0,0001 comparado à metformina. |
Em um segundo estudo de 26 semanas, pacientes com diabetes tipo 2 controlaram inadequadamente 2,5 gramas / dia de metformina e foram randomizados para receber a combinação de AVANDIA 4 mg duas vezes ao dia e A metformina (N = 105) mostrou uma melhora estatisticamente significativa no controle glicêmico, com um efeito médio de tratamento para FPG de -56 mg / dL e um efeito médio de tratamento para HbA1c de -0,8% acima metformina sozinha. A combinação de metformina e AVANDIA resultou em níveis mais baixos de FPG e HbA1c do que qualquer um dos agentes isoladamente.
Pacientes que foram inadequadamente controlados com uma dose máxima (2,5 gramas / dia) de metformina e que foram com monoterapia com AVANDIA demonstrou perda do controle glicêmico, como evidenciado pelo aumento da FPG e HbA1c. Nesse grupo, também foram observados aumentos no LDL e no VLDL.
Combinação com uma sulfonilureia
Um total de 3.457 pacientes com diabetes tipo 2 participou de dez estudos randomizados, duplo-cegos, controlados por placebo / ativo por 24 a 26 semanas e um Estudo de dois anos, duplo-cego, controlado ativo em pacientes idosos, projetado para avaliar a eficácia e segurança de AVANDIA em combinação com um sulfonilureia. AVANDIA 2 mg, 4 mg ou 8 mg por dia foi administrado uma vez ao dia (3 estudos) ou em doses divididas duas vezes ao dia (7 estudos), em pacientes inadequadamente controlados com uma dose submáxima ou máxima de sulfonilureia.
Nestes estudos, a associação de AVANDIA 4 mg ou 8 mg por dia (administrada em doses divididas única ou duas vezes ao dia) e uma sulfonilureia reduziu significativamente a FPG e HbA1c em comparação ao placebo mais sulfonilureia ou maior titulação sulfonilureia. A Tabela 11 mostra os dados reunidos para 8 estudos nos quais AVANDIA adicionado à sulfonilureia foi comparado ao placebo mais sulfonilureia.
Quadro 11 Parâmetros glicêmicos em estudos de combinação de 24 a 26 semanas da AVANDIA Plus Sulfonilureia
| Dosagem dividida duas vezes por dia (5 estudos) | Sulfonilureia N = 397 |
AVANDIA 2 mg duas vezes ao dia + sulfonilureia N = 497 |
Sulfonilureia N = 248 |
AVANDIA 4 mg duas vezes ao dia + sulfonilureia N = 346 |
| FPG (mg / dL) | ||||
| Linha de base (média) | 204 | 198 | 188 | 187 |
| Alterar da linha de base (média) | 11 | -29 | 8 | -43 |
| Diferença da sulfonilureia sozinha (média ajustada) | - | -42* | - | -53* |
| % de pacientes com <30 mg / dL diminuem da linha de base | 17% | 49% | 15% | 61% |
| HbA1c (%) | ||||
| Linha de base (média) | 9.4 | 9.5 | 9.3 | 9.6 |
| Alterar da linha de base (média) | 0.2 | -1.0 | 0.0 | -1.6 |
| Diferença da sulfonilureia sozinha (média ajustada) | - | -1.1* | - | -1.4* |
| % de pacientes com <0,7% de redução em relação à linha de base | 21% | 60% | 23% | 75% |
| Dosagem única diária (3 estudos) | Sulfonilureia N = 172 |
AVANDIA 4 mg uma vez ao dia + sulfonilureia N = 172 |
Sulfonilureia N = 173 |
AVANDIA 8 mg uma vez ao dia + sulfonilureia N = 176 |
| FPG (mg / dL) | ||||
| Linha de base (média) | 198 | 206 | 188 | 192 |
| Alterar da linha de base (média) | 17 | -25 | 17 | -43 |
| Diferença da sulfonilureia sozinha (média ajustada) | - | -47* | - | -66* |
| % de pacientes com <30 mg / dL diminuem da linha de base | 17% | 48% | 19% | 55% |
| HbA1c (%) | ||||
| Linha de base (média) | 8.6 | 8.8 | 8.9 | 8.9 |
| Alterar da linha de base (média) | 0.4 | -0.5 | 0.1 | -1.2 |
| Diferença da sulfonilureia sozinha (média ajustada) | - | -0.9* | - | -1.4* |
| % de pacientes com <0,7% de redução em relação à linha de base | 11% | 36% | 20% | 68% |
| * p <0,0001 comparado à sulfonilureia sozinha. |
Um dos estudos de 24 a 26 semanas incluiu pacientes que foram inadequadamente controlados com doses máximas de gliburida e que mudaram para 4 mg de AVANDIA diariamente como monoterapia; nesse grupo, foi demonstrada a perda do controle glicêmico, como evidenciado pelo aumento da FPG e da HbA1c.
Em um estudo duplo-cego de 2 anos, pacientes idosos (59 a 89 anos) em sulfonilureia meia-máxima (glipizida 10 mg duas vezes ao dia) foram randomizados para a adição de AVANDIA (n = 115,4 mg uma vez ao dia a 8 mg, conforme necessário) ou a titulação contínua da glipizida (n = 110), até um máximo de 20 mg duas vezes diariamente. A média basal de FPG e HbA1c foi de 157 mg / dL e 7,72%, respectivamente, para o braço AVANDIA plus glipizida e 159 mg / dL e 7,65%, respectivamente, para o braço de titulação positiva de glipizida. Ocorreu perda de controle glicêmico (FPG> 180 mg / dL) em uma proporção significativamente menor de pacientes (2%) em uso de AVANDIA mais glipizida em comparação com pacientes no braço de titulação de glipizida (28,7%). Cerca de 78% dos pacientes em terapia combinada completaram os 2 anos de terapia, enquanto apenas 51% completaram a monoterapia com glipizida. O efeito da terapia combinada no FPG e HbA1c foi durável durante o período de estudo de 2 anos, com pacientes atingindo uma média de 132 mg / dL para FPG e uma média de 6,98% para HbA1c em comparação com nenhuma alteração no glipizida braço.
Combinação com sulfonilureia mais metformina
Em dois estudos de 24 a 26 semanas, duplo-cegos, controlados por placebo, projetados para avaliar a eficácia e segurança de AVANDIA em combinação com sulfonilureia mais metformina, AVANDIA 4 mg ou 8 mg diariamente, foi administrado em doses divididas duas vezes ao dia, em pacientes inadequadamente controlados com doses submáximas (10 mg) e máximas (20 mg) de gliburida e dose máxima de metformina (2). g / dia). Foi observada uma melhora estatisticamente significativa no FPG e HbA1c em pacientes tratados com as combinações de sulfonilureia mais metformina e 4 mg de AVANDIA e 8 mg de AVANDIA versus pacientes continuaram em sulfonilureia mais metformina, conforme mostrado na Tabela 12.
Quadro 12 Parâmetros glicêmicos em um estudo de combinação de 26 semanas de AVANDIA Plus Sulfonilureia e Metformina
| Sulfonilureia + metformina N = 273 |
AVANDIA 2 mg duas vezes diariamente + sulfonilureia + metformina N = 276 |
AVANDIA 4 mg duas vezes ao dia + sulfonilureia + metformina N = 277 |
|
| FPG (mg / dL) | |||
| Linha de base (média) | 189 | 190 | 192 |
| Alterar da linha de base (média) | 14 | -19 | -40 |
| Diferença de sulfonilureia mais metformina (média ajustada) | - | -30* | -52* |
| % de pacientes com <30 mg / dL diminuem da linha de base | 16% | 46% | 62% |
| HbA1c (%) | |||
| Linha de base (média) | 8.7 | 8.6 | 8.7 |
| Alterar da linha de base (média) | 0.2 | -0.4 | -0.9 |
| Diferença de sulfonilureia mais metformina (média ajustada) | - | -0.6* | -1.1* |
| % de pacientes com <0,7% de redução em relação à linha de base | 16% | 39% | 63% |
| * p <0,0001 comparado ao placebo. |
topo
Referências
- Documento Informativo da Administração de Alimentos e Medicamentos. Reunião conjunta dos Comitês Consultivos para Endocrinologia e Medicamentos Metabólicos e Segurança e Gerenciamento de Riscos. Ju 2007.
- DREAM Trial Investigators. Efeito da rosiglitazona na frequência do diabetes com tolerância à glicose diminuída ou glicemia de jejum prejudicada: um controle randomizado Lanceta 2006;368:1096-1105.
- Home PD, Pocock SJ, Beck-Nielsen H, et al. A rosiglitazona avaliou os resultados das cardiovas - uma análise interina. NEJM 2007; 357: 1-11.
- Park JY, Kim KA, Kang MH, et al. Efeito da rifampicina na farmacocinética da rosiglitazona em indivíduos saudáveis. Clin Pharmacol Ther 2004; 75: 157-162.
topo
Como Fornecido / Armazenamento e Manuseio
Cada comprimido pentagonal revestido por película TILTAB contém rosiglitazona como maleato, como se segue: 2 mg-de-rosa, com a gravação com SB de um lado e 2 do outro; 4 mg de laranja, gravado com SB de um lado e 4 do outro; 8 mg-marrom-avermelhado, gravado com SB de um lado e 8 do outro.
- Frascos de 2 mg de 60: NDC 0029-3158-18
- Frascos de 4 mg de 30: NDC 0029-3159-13
- Frascos de 4 mg de 90: NDC 0029-3159-00
- Frascos de 8 mg de 30: NDC 0029-3160-13
- Frascos de 8 mg de 90: NDC 0029-3160-59
Armazenar a 25 ° C (77 ° F); excursões de 15 a 30 ° C (59 a 86 ° F). Distribua em um recipiente apertado e resistente à luz.
última atualização 02/2008
Avandia, maleato de rosiglitazona, informações ao paciente (Em inglês simples)
Informações detalhadas sobre sinais, sintomas, causas, tratamentos da diabetes
As informações desta monografia não se destinam a cobrir todos os usos possíveis, instruções, precauções, interações medicamentosas ou efeitos adversos. Esta informação é generalizada e não se destina a aconselhamento médico específico. Se você tiver dúvidas sobre os medicamentos que está tomando ou quiser obter mais informações, consulte seu médico, farmacêutico ou enfermeiro.
de volta a:Procurar todos os medicamentos para diabetes



