Starlix para tratamento de diabetes
Marca: Starlix
Nome genérico: comprimidos de nateglinida
Conteúdo:
Descrição
Farmacologia Clínica
Estudos clínicos
Indicações e uso
Contra-indicações
Precauções
Reações adversas
Sobredosagem
Dosagem e Administração
Como fornecido
Starlix, nateglinida, informações completas do paciente (Em inglês simples)
Descrição
O Starlix® (nateglinida) é um agente antidiabético oral usado no tratamento do diabetes mellitus tipo 2 [também conhecido como diabetes mellitus não dependente de insulina (NIDDM) ou diabetes no adulto]. Starlix, (-) - N - [(trans-4-isopropilciclohexano) carbonil] -D-fenilalanina, não está estruturalmente relacionado com os secretagogos de insulina orais de sulfonilureia.
A fórmula estrutural é como mostrado
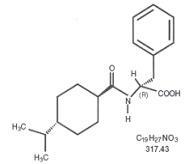
Nateglinida é um pó branco com um peso molecular de 317,43. É livremente solúvel em metanol, etanol e clorofórmio, solúvel em éter, moderadamente solúvel em acetonitrila e octanol e praticamente insolúvel em água. Os comprimidos Starlix biconvexos contêm 60 mg ou 120 mg de nateglinida para administração oral.
Ingredientes inativos: dióxido de silício coloidal, croscarmelose sódica, hidroxipropilmetilcelulose, óxidos de ferro (vermelhos ou amarelo), lactose monohidratada, estearato de magnésio, celulose microcristalina, polietileno glicol, povidona, talco e titânio dióxido.
topo
Farmacologia Clínica
Mecanismo de ação
Nateglinida é um derivado de aminoácido que reduz os níveis de glicose no sangue, estimulando a secreção de insulina do pâncreas. Essa ação depende do funcionamento das células beta nas ilhotas pancreáticas. A nateglinida interage com o canal de potássio sensível ao ATP (K + ATP) nas células beta pancreáticas. A despolarização subsequente da célula beta abre o canal de cálcio, produzindo influxo de cálcio e secreção de insulina. A extensão da liberação de insulina depende da glicose e diminui em níveis baixos de glicose. A nateglinida é altamente seletiva em tecidos com baixa afinidade para o coração e os músculos esqueléticos.
Farmacocinética
Absorção
Após administração oral imediatamente antes de uma refeição, a nateglinida é rapidamente absorvida com o pico médio das concentrações plasmáticas de fármacos (Cmax) ocorrendo geralmente dentro de 1 hora (Tmax) após a administração. Quando administrado a pacientes com diabetes tipo 2 na faixa de dosagem de 60 a 240 mg três vezes ao dia por um semana, a nateglinida demonstrou farmacocinética linear tanto para AUC (área sob a curva de tempo / concentração plasmática) quanto Cmax. Tmax também foi considerado independente da dose nessa população de pacientes. A biodisponibilidade absoluta é estimada em aproximadamente 73%. Quando administrado com ou após as refeições, a extensão da absorção da nateglinida (AUC) permanece inalterada. No entanto, existe um atraso na taxa de absorção, caracterizado por uma diminuição na Cmax e um atraso no tempo para atingir o pico da concentração plasmática (Tmax). Os perfis plasmáticos são caracterizados por múltiplos picos de concentração plasmática quando a nateglinida é administrada em condições de jejum. Este efeito é diminuído quando a nateglinida é tomada antes de uma refeição.
Distribuição
Com base nos dados após a administração intravenosa (nativa) de nateglinida, o volume de distribuição no estado estacionário da nateglinida é estimado em aproximadamente 10 litros em indivíduos saudáveis. A nateglinida está extensivamente ligada (98%) às proteínas séricas, principalmente albumina sérica, e em menor extensão à glicoproteína ácida a1. A extensão da ligação às proteínas séricas é independente da concentração do medicamento no intervalo de teste de 0,1-10 µg / mL.
Metabolismo
A nateglinida é metabolizada pelo sistema oxidase de função mista antes da eliminação. As principais vias do metabolismo são a hidroxilação seguida pela conjugação de glucuronídeo. Os principais metabólitos são agentes antidiabéticos menos potentes que a nateglinida. O metabolito menor de isopreno possui uma potência semelhante à do composto original nateglinida.
Dados in vitro demonstram que a nateglinida é predominantemente metabolizada pelas isoenzimas do citocromo P450 CYP2C9 (70%) e CYP3A4 (30%).
Excreção
A nateglinida e os seus metabolitos são rápida e completamente eliminados após administração oral. Dentro de 6 horas após a administração, aproximadamente 75% da 14C-nateglinida administrada foi recuperada na urina. Oitenta e três por cento da nateglinida 14C foram excretados na urina, com 10% adicionais eliminados nas fezes. Aproximadamente 16% da 14C-nateglinida foram excretados na urina como composto original. Em todos os estudos de voluntários saudáveis e pacientes com diabetes tipo 2, as concentrações plasmáticas de nateglinida diminuíram rapidamente, com uma meia-vida de eliminação média de aproximadamente 1,5 horas. Consistente com esta curta semi-vida de eliminação, não houve acumulação aparente de nateglinida após doses múltiplas de até 240 mg, três vezes ao dia, durante 7 dias.
Interações medicamentosas
Estudos de metabolismo de drogas in vitro indicam que Starlix é predominantemente metabolizado pela isozima do citocromo P450 CYP2C9 (70%) e, em menor grau, pelo CYP3A4 (30%). Starlix é um inibidor potencial da isoenzima CYP2C9 in vivo, conforme indicado por sua capacidade de inibir o metabolismo in vitro da tolbutamida. A inibição das reações metabólicas do CYP3A4 não foi detectada em experimentos in vitro.
Gliburida: em um estudo randomizado, cruzado de doses múltiplas, pacientes com diabetes tipo 2 foram administrou Starlix 120 mg três vezes ao dia antes das refeições por 1 dia em combinação com gliburida 10 mg por dia. Não houve alterações clinicamente relevantes na farmacocinética de nenhum dos agentes.
Metformina: quando Starlix 120 mg três vezes ao dia antes das refeições foi administrado em combinação com metformina 500 mg três vezes ao dia para pacientes com diabetes tipo 2, não houve alterações clinicamente relevantes na farmacocinética de agente.
Digoxina: Quando Starlix 120 mg antes das refeições foi administrado em combinação com uma dose única de 1 mg de digoxina para voluntários saudáveis, não houve alterações clinicamente relevantes na farmacocinética de agente.
Varfarina: Quando indivíduos saudáveis foram administrados Starlix 120 mg três vezes ao dia antes das refeições por quatro dias combinação com uma dose única de 30 mg de varfarina no dia 2, não houve alterações na farmacocinética de agente. O tempo de protrombina não foi afetado.
Diclofenaco: Administração de doses de Starlix 120 de manhã e almoço, em combinação com uma dose única de 75 mg. A dose de diclofenaco em voluntários saudáveis não resultou em alterações significativas na farmacocinética de agente.
Populações Especiais
Geriátrico: a idade não influenciou as propriedades farmacocinéticas da nateglinida. Portanto, não são necessários ajustes de dose em pacientes idosos.
Sexo: Não foram observadas diferenças clinicamente significativas na farmacocinética da nateglinida entre homens e mulheres. Portanto, nenhum ajuste de dose com base no sexo é necessário.
Raça: Os resultados de uma análise farmacocinética da população, incluindo indivíduos de origem caucasiana, negra e outras etnias, sugerem que a raça tem pouca influência na farmacocinética da nateglinida.
Compromisso renal: em comparação com indivíduos saudáveis, pacientes com diabetes tipo 2 e insuficiência renal moderada a grave (CrCl 15-50 mL / min), não em diálise, apresentou aparente depuração, AUC e Cmax. Pacientes com diabetes tipo 2 e insuficiência renal em diálise exibiram exposição geral reduzida ao medicamento. No entanto, os pacientes em hemodiálise também apresentaram reduções na ligação às proteínas plasmáticas em comparação com os voluntários saudáveis correspondentes.
Insuficiência hepática: O pico e a exposição total da nateglinida em indivíduos não diabéticos com insuficiência hepática leve foram aumentados em 30% em comparação com indivíduos saudáveis pareados. Starlix® (nateglinida) deve ser usado com cautela em pacientes com doença hepática crônica. (Ver PRECAUÇÕES, Insuficiência hepática.)
Farmacodinâmica
O Starlix é rapidamente absorvido e estimula a secreção pancreática de insulina dentro de 20 minutos após a administração oral. Quando o Starlix é administrado três vezes ao dia antes das refeições, ocorre um rápido aumento da insulina plasmática, com níveis de pico aproximadamente 1 hora após a administração e uma queda na linha de base em 4 horas após a administração.
Em um ensaio clínico controlado, duplo-cego, no qual Starlix foi administrado antes de cada um dos três as refeições, os níveis plasmáticos de glicose foram determinados por um período diurno de 12 horas após 7 semanas de tratamento. Starlix foi administrado 10 minutos antes das refeições. As refeições foram baseadas em menus padrão de manutenção do peso diabético, com o conteúdo calórico total baseado na altura de cada sujeito. Starlix produziu reduções estatisticamente significativas na glicemia de jejum e pós-prandial em comparação com o placebo.
topo
Estudos clínicos
Um total de 3.566 pacientes foram randomizados em nove estudos duplo-cegos, controlados por placebo ou ativos, com duração de 8 a 24 semanas, para avaliar a segurança e eficácia de Starlix® (nateglinida). 3.513 pacientes apresentaram valores de eficácia além da linha de base. Nestes estudos, o Starlix foi administrado até 30 minutos antes de cada uma das três refeições principais diárias.
Monoterapia Starlix® em comparação com placebo
Em um estudo randomizado, duplo-cego, controlado por placebo e de 24 semanas, pacientes com diabetes tipo 2 com HbA1C> 6,8% apenas na dieta foram randomizados para receber Starlix (60 mg ou 120 mg três vezes ao dia antes das refeições) ou placebo. A HbA1C basal variou de 7,9% a 8,1% e 77,8% dos pacientes não foram tratados anteriormente com terapia antidiabética oral. Os pacientes tratados anteriormente com medicamentos antidiabéticos foram obrigados a interromper o medicamento por pelo menos 2 meses antes da randomização. A adição de Starlix antes das refeições resultou em reduções estatisticamente significativas da HbA1C e da glicose plasmática em jejum (FPG) em comparação com o placebo (consulte a Tabela 1). As reduções em HbA1C e FPG foram semelhantes para pacientes ingênuos e previamente expostos a medicamentos antidiabéticos.
Neste estudo, um episódio de hipoglicemia grave (glicose plasmática <36 mg / dL) foi relatado em um paciente tratado com Starlix 120 mg três vezes ao dia antes das refeições. Nenhum paciente apresentou hipoglicemia que necessitou de assistência de terceiros. Os pacientes tratados com Starlix tiveram aumentos médios estatisticamente significativos no peso em comparação com o placebo (consulte a Tabela 1).
Em outro estudo randomizado, duplo-cego, 24 semanas, controlado por ativo e placebo, pacientes com diabetes tipo 2 foram randomizados para receber Starlix (120 mg três vezes) diariamente antes das refeições), metformina 500 mg (três vezes ao dia), uma combinação de Starlix 120 mg (três vezes ao dia antes das refeições) e metformina 500 mg (três vezes ao dia) ou placebo. A linha de base HbA1C variou de 8,3% a 8,4%. Cinquenta e sete por cento dos pacientes não foram tratados anteriormente com terapia antidiabética oral. A monoterapia com Starlix resultou em reduções significativas na média de HbA1C e média de FPG em comparação ao placebo, semelhantes aos resultados do estudo relatado acima (consulte a Tabela 2).
Tabela 1: Resultados finais para um estudo de 24 semanas com dose fixa de Starlix® em monoterapia
|
Placebo |
Starlix® 60 mg três vezes diariamente antes das refeições |
Starlix® 120 mg três vezes diariamente antes das refeições |
|
| HbA1C (%) | N = 168 | N = 167 | N = 168 |
| Linha de base (média) | 8.0 | 7.9 | 8.1 |
| Alterar da linha de base (média) | +0.2 | -0.3 | -0.5 |
| Diferença do placebo (média) | -0.5 uma | -0.7 uma | |
| FPG (mg / dL) | N = 172 | N = 171 | N = 169 |
| Linha de base (média) | 167.9 | 161.0 | 166.5 |
| Alterar da linha de base (média) | +9.1 | +0.4 | -4.5 |
| Diferença do placebo (média) | -8.7 uma | -13.6 uma | |
| Peso (kg) | N = 170 | N = 169 | N = 166 |
| Linha de base (média) | 85.8 | 83.7 | 86.3 |
| Alterar da linha de base (média) | -0.7 | +0.3 | +0.9 |
| Diferença do placebo (média) | +1.0 uma | +1.6 uma |
um valor p <0,004
Starlix® em monoterapia em comparação com outros agentes antidiabéticos orais
Gliburida
Em um estudo de 24 semanas, duplo-cego, com controle ativo, pacientes com diabetes tipo 2 que estavam em sulfonilureia por mais de três meses e que teve um HbA1C inicial> 6,5% randomizado para receber Starlix (60 mg ou 120 mg três vezes ao dia antes das refeições) ou gliburida 10 mg uma vez diariamente. Os pacientes randomizados para Starlix tiveram aumentos significativos na média de HbA1C e média de FPG no endpoint em comparação aos pacientes randomizados para gliburida.
Metformina
Em outro estudo randomizado, duplo-cego, 24 semanas, controlado por ativo e placebo, pacientes com diabetes tipo 2 foram randomizados para receber Starlix (120 mg três vezes) diariamente antes das refeições), metformina 500 mg (três vezes ao dia), uma combinação de Starlix 120 mg (três vezes ao dia antes das refeições) e metformina 500 mg (três vezes ao dia) ou placebo. A linha de base HbA1C variou de 8,3% a 8,4%. Cinquenta e sete por cento dos pacientes não foram tratados anteriormente com terapia antidiabética oral. As reduções na média de HbA1C e média de FPG no endpoint com metformina em monoterapia foram significativamente maiores do que as reduções nessas variáveis com Starlix em monoterapia (ver Tabela 2). Em relação ao placebo, a Starlix em monoterapia foi associada a aumentos significativos no peso médio, enquanto a metformina em monoterapia foi associada a reduções significativas no peso médio. Entre o subconjunto de pacientes sem terapia antidiabética, as reduções na HbA1C média e na FPG média para a monoterapia com Starlix foram semelhantes às da monoterapia com metformina (ver Tabela 2). Entre o subconjunto de pacientes tratados anteriormente com outros agentes antidiabéticos, principalmente a gliburida, a HbA1C no Starlix grupo monoterapia aumentou ligeiramente em relação à linha de base, enquanto a HbA1C foi reduzida no grupo monoterapia com metformina (ver Tabela 2).
Terapia combinada Starlix®
Metformina
Em outro estudo randomizado, duplo-cego, 24 semanas, controlado por ativo e placebo, pacientes com diabetes tipo 2 foram randomizados para receber Starlix (120 mg três vezes) diariamente antes das refeições), metformina 500 mg (três vezes ao dia), uma combinação de Starlix 120 mg (três vezes ao dia antes das refeições) e metformina 500 mg (três vezes ao dia) ou placebo. A linha de base HbA1C variou de 8,3% a 8,4%. Cinquenta e sete por cento dos pacientes não foram tratados anteriormente com terapia antidiabética oral. Os pacientes tratados anteriormente com medicamentos antidiabéticos foram obrigados a interromper a medicação por pelo menos 2 meses antes da randomização. A combinação de Starlix e metformina resultou em reduções estatisticamente maiores em HbA1C e FPG em comparação com Starlix ou metformina em monoterapia (consulte a Tabela 2). Starlix, sozinho ou em combinação com a metformina, reduziu significativamente a elevação da glicose prandial da pré-refeição para 2 horas após a refeição, em comparação com o placebo e a metformina isoladamente.
Neste estudo, um episódio de hipoglicemia grave (glicemia plasmática <36 mg / dL) foi relatado em um paciente que recebeu o Foi relatada a combinação de Starlix e metformina e quatro episódios de hipoglicemia grave em um único paciente na metformina braço de tratamento. Nenhum paciente apresentou um episódio de hipoglicemia que necessitou de assistência de terceiros. Comparado ao placebo, a Starlix em monoterapia foi associada a um aumento estatisticamente significativo no peso, embora nenhuma mudança significativa no peso tenha sido observada com a terapia combinada Starlix e metformina (consulte a Tabela 2).
Em outro estudo de 24 semanas, duplo-cego, controlado por placebo, pacientes com diabetes tipo 2 com HbA1C> 6,8% após o tratamento com metformina (> 1500 mg por dia durante> 1 mês) foram inseridos pela primeira vez em um período inicial de quatro semanas de monoterapia com metformina (2000 mg por dia) e randomizado para receber Starlix (60 mg ou 120 mg três vezes ao dia antes das refeições) ou placebo, além da metformina. A terapia combinada com Starlix e metformina foi associada a reduções estatisticamente significativamente maiores HbA1C em comparação com a metformina em monoterapia (-0,4% e -0,6% para Starlix 60 mg e Starlix 120 mg mais metformina, respectivamente).
Tabela 2: Resultados finais para um estudo de 24 semanas de Starlix®monoterapia e combinação com metformina
|
Placebo |
Starlix® 120 mg três vezes diariamente antes refeições |
Metformina 500 mg três vezes diariamente |
Starlix® 120 mg antes refeições mais Metformina * |
|
| HbA1C (%) | ||||
| Todos | N = 160 | N = 171 | N = 172 | N = 162 |
| Linha de base (média) | 8.3 | 8.3 | 8.4 | 8.4 |
| Alterar da linha de base (média) | +0.4 | -0.4 bc | -0.8 c | -1.5 |
| Diferença do placebo | -0.8 uma | -1.2 uma | -1.9 uma | |
| NaÑve | N = 98 | N = 99 | N = 98 | N = 81 |
| Linha de base (média) | 8.2 | 8.1 | 8.3 | 8.2 |
| Alterar da linha de base (média) | +0.3 | -0.7 c | -0.8 c | -1.6 |
| Diferença do placebo | -1.0 uma | -1.1 uma | -1.9 uma | |
| Não-na-ve | N = 62 | N = 72 | N = 74 | N = 81 |
| Linha de base (média) | 8.3 | 8.5 | 8.7 | 8.7 |
| Alterar da linha de base (média) | +0.6 | +0.004 bc | -0.8 c | -1.4 |
| Diferença do placebo | -0.6 uma | -1.4 uma | -2.0 uma | |
| FPG (mg / dL) | ||||
| Todos | N = 166 | N = 173 | N = 174 | N = 167 |
| Linha de base (média) | 194.0 | 196.5 | 196.0 | 197.7 |
| Alterar da linha de base (média) | +8.0 | -13.1 bc | -30.0 c | -44.9 |
| Diferença do placebo | -21.1 uma | -38.0 uma | -52.9 uma | |
| Peso (kg) | ||||
| Todos | N = 160 | N = 169 | N = 169 | N = 160 |
| Linha de base (média) | 85.0 | 85.0 | 86.0 | 87.4 |
| Alterar da linha de base (média) | -0.4 | +0.9 bc | -0.1 | +0.2 |
| Diferença do placebo | +1.3 uma | +0.3 | +0.6 |
um valor p <0,05 vs. placebo
b valor p <0,03 vs. metformina
c valor p <0,05 vs. combinação
* A metformina foi administrada três vezes ao dia
Rosiglitazona
Um estudo multicêntrico de 24 semanas, duplo-cego, controlado por placebo foi realizado em pacientes com diabetes tipo 2 diabetes não adequadamente controlado após uma resposta terapêutica à rosiglitazona em monoterapia 8 mg diariamente. A adição de Starlix (120 mg três vezes ao dia com as refeições) foi associada a reduções estatisticamente maiores na HbA1C em comparação com a monoterapia com rosiglitazona. A diferença foi de -0,77% em 24 semanas. A alteração média no peso em relação à linha de base foi de cerca de +3 kg para pacientes tratados com Starlix mais rosiglitazona vs cerca de +1 kg para pacientes tratados com placebo e rosiglitazona.
Gliburida
Em um estudo de 12 semanas de pacientes com diabetes tipo 2 inadequadamente controlado com 10 mg de gliburida uma vez ao dia, a adição de Starlix (60 mg ou 120 mg três vezes ao dia antes das refeições) não produziu nenhum efeito adicional. benefício.
topo
Indicações e uso
Starlix® (nateglinida) é indicado como um complemento da dieta e do exercício para melhorar o controle glicêmico em adultos com diabetes mellitus tipo 2.
topo
Contra-indicações
Starlix® (nateglinida) está contra-indicado em pacientes com:
1. Hipersensibilidade conhecida ao medicamento ou a seus ingredientes inativos.
2. Diabetes tipo 1.
3. Cetoacidose diabética. Esta condição deve ser tratada com insulina.
topo
Precauções
Resultados Macrovasculares: Não houve estudos clínicos estabelecendo evidências conclusivas de redução de risco macrovascular com Starlix ou qualquer outro medicamento antidiabético.
Hipoglicemia: Todos os medicamentos orais para baixar a glicose no sangue que são absorvidos sistemicamente são capazes de produzir hipoglicemia. A frequência da hipoglicemia está relacionada à gravidade do diabetes, ao nível de controle glicêmico e a outras características do paciente. Pacientes geriátricos, desnutridos e pacientes com insuficiência adrenal ou pituitária ou insuficiência renal grave são mais suscetíveis ao efeito de redução da glicose desses tratamentos. O risco de hipoglicemia pode ser aumentado por exercícios físicos extenuantes, ingestão de álcool, ingestão calórica insuficiente de forma aguda ou crônica, ou combinações com outros antidiabéticos orais agentes. Pode ser difícil reconhecer a hipoglicemia em pacientes com neuropatia autonômica e / ou naqueles que usam betabloqueadores. Starlix® (nateglinida) deve ser administrado antes das refeições para reduzir o risco de hipoglicemia. Os pacientes que pulam as refeições também devem pular a dose programada de Starlix para reduzir o risco de hipoglicemia.
Compromisso hepático: Starlix deve ser utilizado com precaução em doentes com doença hepática moderada a grave, porque esses doentes não foram estudados.
Perda do controle glicêmico
Pode ocorrer perda transitória do controle glicêmico com febre, infecção, trauma ou cirurgia. A terapia com insulina pode ser necessária em vez da terapia Starlix nesses momentos. Pode ocorrer falha secundária ou eficácia reduzida do Starlix por um período de tempo.
Informação para Pacientes
Os pacientes devem ser informados sobre os riscos e benefícios potenciais do Starlix e sobre os modos alternativos de terapia. Os riscos e o manejo da hipoglicemia devem ser explicados. Os pacientes devem ser instruídos a tomar Starlix 1 a 30 minutos antes de ingerir uma refeição, mas a pular a dose programada se eles pularem a refeição, para que o risco de hipoglicemia seja reduzido. As interações medicamentosas devem ser discutidas com os pacientes. Os pacientes devem ser informados sobre possíveis interações medicamentosas com Starlix.
Testes laboratoriais
A resposta às terapias deve ser avaliada periodicamente com os valores de glicose e os níveis de HbA1C.
Interações medicamentosas
A nateglinida é altamente ligada às proteínas plasmáticas (98%), principalmente a albumina. Estudos de deslocamento in vitro com drogas altamente ligadas a proteínas, como furosemida, propranolol, captopril, nicardipina, pravastatina, gliburida, varfarina, fenitoína, ácido acetilsalicílico, tolbutamida e metformina não mostraram influência na extensão da proteína nateglinida obrigatório. Da mesma forma, a nateglinida não teve influência sobre a ligação sérica de propranolol, gliburida, nicardipina, varfarina, fenitoína, ácido acetilsalicílico e tolbutamida in vitro. No entanto, é necessária uma avaliação prudente de casos individuais no contexto clínico.
Certos medicamentos, incluindo agentes anti-inflamatórios não esteróides (AINEs), salicilatos, inibidores da monoamina oxidase e agentes bloqueadores beta-adrenérgicos não seletivos podem potencializar a ação hipoglicêmica do Starlix e de outros antidiabéticos orais drogas.
Certos medicamentos, incluindo tiazidas, corticosteróides, produtos da tireóide e simpatomiméticos, podem reduzir a ação hipoglicêmica do Starlix e de outros medicamentos antidiabéticos orais.
Quando esses medicamentos são administrados ou retirados de pacientes recebendo Starlix, o paciente deve ser observado de perto quanto a alterações no controle glicêmico.
Interações Medicamentosas / Alimentares
A farmacocinética da nateglinida não foi afetada pela composição de uma refeição (alta proteína, gordura ou carboidrato). No entanto, os níveis plasmáticos máximos foram significativamente reduzidos quando Starlix foi administrado 10 minutos antes de uma refeição líquida. Starlix não teve nenhum efeito no esvaziamento gástrico em indivíduos saudáveis, conforme avaliado pelo teste de acetaminofeno.
Carcinogênese / mutagênese / comprometimento da fertilidade
Carcinogenicidade: Foi realizado um estudo de carcinogenicidade de dois anos em ratos Sprague-Dawley com doses orais de nateglinida até 900 mg / kg / dia, que produziram exposições à AUC em ratos machos e fêmeas aproximadamente 30 e 40 vezes a exposição terapêutica humana, respectivamente, com uma dose recomendada de Starlix de 120 mg, três vezes ao dia antes refeições. Foi realizado um estudo de carcinogenicidade de dois anos em camundongos B6C3F1 com doses orais de nateglinida até 400 mg / kg / dia, que produziram exposições à AUC em homens e camundongos fêmeas aproximadamente 10 e 30 vezes a exposição terapêutica humana com uma dose recomendada de Starlix de 120 mg, três vezes ao dia antes das refeições. Nenhuma evidência de resposta tumorigênica foi encontrada em ratos ou camundongos.
Mutagênese: A nateglinida não foi genotóxica no teste Ames in vitro, no teste de linfoma de camundongo, no teste de aberração cromossômica em células pulmonares de hamster chinês ou no teste de micronúcleo de camundongo in vivo.
Comprometimento da fertilidade: a fertilidade não foi afetada pela administração de nateglinida a ratos em doses de até 600 mg / kg (aproximadamente 16 vezes a exposição terapêutica humana com uma dose recomendada de Starlix de 120 mg, três vezes ao dia antes refeições).
Gravidez
Gravidez Categoria C
A nateglinida não era teratogênica em ratos com doses de até 1000 mg / kg (aproximadamente 60 vezes a exposição terapêutica humana com uma dose recomendada de Starlix de 120 mg, três vezes ao dia antes das refeições). No coelho, o desenvolvimento embrionário foi afetado adversamente e a incidência de agenesia da vesícula biliar ou pequena vesícula biliar aumentou dose de 500 mg / kg (aproximadamente 40 vezes a exposição terapêutica humana com uma dose Starlix recomendada de 120 mg, três vezes ao dia antes refeições). Não existem estudos adequados e bem controlados em mulheres grávidas. Starlix não deve ser utilizado durante a gravidez.
Trabalho e entrega
O efeito do Starlix no trabalho de parto e parto em humanos não é conhecido.
Mães que amamentam
Estudos em ratos lactantes mostraram que a nateglinida é excretada no leite; a proporção AUC0-48h no leite para o plasma era de aproximadamente 1: 4. Durante o período per e pós-natal, os pesos corporais foram menores na prole de ratos administrados com nateglinida a 1000 mg / kg (aproximadamente 60 vezes a exposição terapêutica humana com uma dose Starlix recomendada de 120 mg, três vezes ao dia antes refeições). Não se sabe se Starlix é excretado no leite humano. Como muitos medicamentos são excretados no leite humano, Starlix não deve ser administrado a uma mulher que amamenta.
Uso pediátrico
A segurança e eficácia de Starlix em pacientes pediátricos não foram estabelecidas.
Uso Geriátrico
Não foram observadas diferenças na segurança ou eficácia de Starlix entre os pacientes com 65 anos ou mais e aqueles com menos de 65 anos. No entanto, uma maior sensibilidade de alguns indivíduos mais velhos à terapia Starlix não pode ser descartada.
topo
Reações adversas
Em ensaios clínicos, aproximadamente 2.600 pacientes com diabetes tipo 2 foram tratados com Starlix® (nateglinida). Desses, aproximadamente 1.335 pacientes foram tratados por 6 meses ou mais e aproximadamente 190 pacientes por um ano ou mais.
A hipoglicemia era relativamente incomum em todos os ramos de tratamento dos ensaios clínicos. Apenas 0,3% dos pacientes Starlix descontinuaram devido à hipoglicemia. Os sintomas gastrointestinais, especialmente diarréia e náusea, não foram mais comuns em pacientes que usaram a combinação de Starlix e metformina do que em pacientes que receberam metformina isoladamente. Da mesma forma, o edema periférico não foi mais comum em pacientes que usaram a combinação de Starlix e rosiglitazona do que em pacientes que receberam apenas rosiglitazona. A tabela a seguir lista os eventos que ocorreram com mais frequência em pacientes Starlix do que pacientes placebo em ensaios clínicos controlados.
Eventos adversos comuns (± 2% nos pacientes Starlix®) nos ensaios com monoterapia Starlix® (% dos pacientes)
| Placebo | Starlix® | |
| N = 458 | N = 1441 | |
| Termo preferido | ||
| Infecção Respiratória Superior | 8.1 | 10.5 |
| Dor nas costas | 3.7 | 4.0 |
| Sintomas de gripe | 2.6 | 3.6 |
| Tontura | 2.2 | 3.6 |
| Artropatia | 2.2 | 3.3 |
| Diarréia | 3.1 | 3.2 |
| Trauma acidental | 1.7 | 2.9 |
| Bronquite | 2.6 | 2.7 |
| Tosse | 2.2 | 2.4 |
| Hipoglicemia | 0.4 | 2.4 |
Durante a experiência pós-comercialização, foram relatados casos raros de reações de hipersensibilidade, como erupção cutânea, prurido e urticária. Da mesma forma, foram relatados casos de icterícia, hepatite colestática e enzimas hepáticas elevadas.
Anormalidades laboratoriais
Ácido úrico: Houve aumento nos níveis médios de ácido úrico para pacientes tratados apenas com Starlix, Starlix em combinação com metformina, metformina isolada e gliburida isolada. As respectivas diferenças em relação ao placebo foram 0,29 mg / dL, 0,45 mg / dL, 0,28 mg / dL e 0,19 mg / dL. O significado clínico destes resultados é desconhecido.
topo
Sobredosagem
Num estudo clínico em pacientes com diabetes tipo 2, Starlix® (nateglinida) foi administrado em doses crescentes até 720 mg por dia durante 7 dias e não houve eventos adversos clinicamente significativos relatado. Não houve casos de sobredosagem com Starlix em ensaios clínicos. No entanto, uma overdose pode resultar em um efeito exagerado de redução da glicose com o desenvolvimento de sintomas hipoglicêmicos. Os sintomas hipoglicêmicos sem perda de consciência ou achados neurológicos devem ser tratados com glicose oral e ajustes nos padrões de dosagem e / ou refeição. Reações hipoglicêmicas graves com coma, convulsões ou outros sintomas neurológicos devem ser tratadas com glicose intravenosa. Como a nateglinida é altamente ligada às proteínas, a diálise não é um meio eficiente de removê-la do sangue.
topo
Dosagem e Administração
Starlix® (nateglinida) deve ser tomado 1 a 30 minutos antes das refeições.
Monoterapia e combinação com metformina ou tiazolidinediona
A dose inicial e de manutenção recomendada de Starlix, isoladamente ou em combinação com metformina ou uma tiazolidinediona, é de 120 mg três vezes ao dia antes das refeições.
A dose de 60 mg de Starlix, isoladamente ou em combinação com metformina ou uma tiazolidinediona, pode ser usada em pacientes que estão próximos da meta HbA1C quando o tratamento é iniciado.
Dosagem em pacientes geriátricos
Geralmente, não são necessários ajustes especiais de dose. No entanto, uma maior sensibilidade de alguns indivíduos à terapia Starlix não pode ser descartada.
Dosagem na insuficiência renal e hepática
Não é necessário ajuste posológico em pacientes com insuficiência renal leve a grave ou em pacientes com insuficiência hepática leve. A dosagem de pacientes com disfunção hepática moderada a grave não foi estudada. Por conseguinte, Starlix deve ser utilizado com precaução em doentes com doença hepática moderada a grave (ver PRECAUÇÕES, Compromisso hepático).
topo
Como fornecido
Starlix® (nateglinida) comprimidos
60 mg
Comprimido rosa, redondo e chanfrado com borda "Starlix" gravada em um lado e "60" no outro.
Garrafas de 100... NDC 0078-0351-05
120 mg
Comprimido amarelo ovalóide com "Starlix" gravado em um lado e "120" no outro.
Garrafas de 100... NDC 0078-0352-05
Armazenamento
Armazenar a 25 ºC (77 ºF); excursões permitidas a 15 ºC-30 ºC (59 ºF-86 ºF).
Dispensar em um recipiente apertado, USP.
T2008-01
REV: JULHO DE 2008
Fabricado por:
Novartis Pharma Stein AG
Stein, Suíça
Distribuído por:
Novartis Pharmaceuticals Corporation
East Hanover, Nova Jersey 07936
© Novartis
Última atualização 07/2008
Starlix, nateglinida, informações completas do paciente (Em inglês simples)
Informações detalhadas sobre sinais, sintomas, causas, tratamentos da diabetes
As informações desta monografia não se destinam a cobrir todos os usos possíveis, instruções, precauções, interações medicamentosas ou efeitos adversos. Esta informação é generalizada e não se destina a aconselhamento médico específico. Se você tiver dúvidas sobre os medicamentos que está tomando ou quiser obter mais informações, consulte seu médico, farmacêutico ou enfermeiro.
de volta a: Procurar todos os medicamentos para diabetes



